|
|
2.4
|
Synthese der 4-pyridyl-substituierten Pyridinium-N-phenolat-Betainfarbstoffe |
|
2.4.1
|
Synthese von 4-Amino-2,6-bis(4-pyridyl)phenol 50 |
|
2.4.1.1
|
Herstellung von 1,3-Bis(4-pyridyl)propan-2-ol 46 |
|
In einen 1l-Dreihalskolben mit Gaseinlaß, KPG-Rührer und Tieftemperaturkühler werden 400 ml Ammoniak bei – 50 °C einkondensiert. Dazu werden 1.00 g (0.43 mol) Natrium und 1.00 g Eisen(III)nitrat zugegeben. Dann werden langsam weitere 8.29 g (0.36 mol) Natrium zugegeben. Nach dem Ende der Wasserstoffentwicklung erhält man eine graue Suspension von Natriumamid. Dazu gibt man innerhalb von 30 min. 37.25 g (0.40 mol; 39 ml) 4-Methylpyridin in 50 ml Diethylether. Die entstehende, tiefrote Lösung läßt man 1 h rühren, dann läßt man innerhalb von 30 min. 14.82 g (0.20 mol; 16 ml) Ameisensäureethylester zutropfen und eine weitere Stunde rühren. Dann gibt man 200 g festes Ammoniumchlorid und anschließend 300 ml Diethylether in das Reaktionsgemisch und läßt den Ammoniak entweichen. Nun werden 300 ml Wasser zugegeben und die Etherphase abgetrennt. Die wäßrige Phase wird dreimal mit je 200 ml Diethylether extrahiert. Die vereinigten organischen Phasen werden mit Magnesiumsulfat getrocknet und das Lösungsmittel wird im Rotationsverdampfer abdestilliert. Der erhaltene Feststoff wird aus 200 ml Essigsäureethylester umkristallisiert. Man erhält 25.71 g (0.12 mol; 60 %) 46 als einen rotbraunen Feststoff mit einem Schmelzpunkt von 97 - 98 °C. |
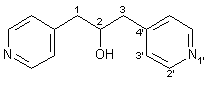
|
1 H-NMR (200 MHz, CDCl3): |
|
|
|
2.50 - 2.69 (m, 4H, AB-Teil des ABX-Systems, 1-H, 3-H), 3.87 (quin, 1H, X-Teil des ABX-Systems, 2-H), 6.00 (s, 1H, OH), 6.93 (d, 4H, 3J3‘,2‘ = 6 Hz, 3‘-H), 8.02 (d, 4H, , 3J2‘,3‘ = 6 Hz, 2‘-H). |
|
13 C-NMR (50 MHz, CDCl3): |
|
|
|
42.9 (C-1, C-3), 70.8 (C-2), 124.6, 148.1, 148.5 (C-2‘, C-3‘, C-4‘). |
|
MS (EI): |
|
|
m/z (%) = |
214 (24) [M+]. |
|
IR(KBr): |
|
|
|
3144 (w, OH), 2941 (s, CH2-Valenzschwingungen),1600 (s) und 1558 (m, Pyridin), 1414 (m, CH2-Deformationsschwingungen), 1220 (s, Deformations- schwingung in Aromaten), 1075 (m, sekundärer Alkohol), 805 (s), 794 (s, Deformationsschwingung in Aromaten). |
|
Elementaranalyse: |
||||
|
C13H14N2O x 1/6 H2O (214.3 + 3.0 = 217.3) |
||||
|
Ber. (%) : Gef. (%) : |
C 71.87 C 72.01 |
H 6.65 H 6.35 |
N 12.89 N 12.74 |
|
|
2.4.1.2
|
Herstellung von 1,3-Bis(4-pyridyl)propan-2-on 47 |
|
Zu einer frisch angesetzten Natriumethanolatlösung, hergestellt aus 2.30 g (0.10 mol) Natrium und 100 ml Ethanol, werden innerhalb von 30 min 16.52 (0.10 mol) (4-Pyridyl)-essigsäureethylester 48 zugetropft. Die Mischung wird 12 h bei 60 – 70 °C gerührt, dann läßt man abkühlen, gibt 80 ml konz. HCl zu und erhitzt die Lösung für 3 h unter Rückfluß. Nach dem Abkühlen werden 100 ml Wasser zugegeben und zweimal mit je 100 ml Chloroform gewaschen. Dann gibt man 10 proz. Natronlauge zur wäßrigen Phase zu, bis diese alkalisch reagiert. Die wäßrige Phase wird dreimal mit je 100 ml Chloroform extrahiert. Die vereinigten organischen Extrakte werden mit Magnesiumsulfat getrocknet und im Rotationsverdampfer eingeengt. Man erhält ein braunes Öl, das durch Flash-Chromatographie (Ethanol; RF-Wert: 0.33) gereinigt wird. Man erhält 0.21 g (1.00 mmol, 2 %) 47 als wachsartigen, braunen Feststoff mit einem Schmelpunkt von 65 – 67 °C. |
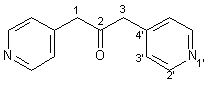
|
1 H-NMR (200 MHz, CDCl3): |
|
|
|
3.73 (s, 4H, 1-H, 3-H), 7.04 (d, 4H, 3J3‘, 2‘ = 4.6 Hz, 3‘-H), 8.49 (d, 4H, 3J2‘, 3‘ = 4.6 Hz, 2‘-H). |
|
13 C-NMR (50 MHz, CDCl3): |
|
|
|
48.4 (C-1, C-3), 124.7, 142.0, 150.1 (C-2‘, C-3‘, C-4‘), 201.7 (C-2). |
|
MS (EI): |
|
|
m/z (%) = |
92 (52) [C5H4N-CH2], 93 (100) [C5H4N-CH3], 120 (28) [C5H4N-CH2CO], 212 (2.4) [M+]. |
|
IR(KBr): |
|
|
|
3413 (w, OH), 3023 (s, C-H-aromatische Schwingungen), 2903 (CH2-Valenz), 1712 (s, C=O), 1604 (m) und 1561 (m, Pyridin), 1413 (m, CH2-Deformations- schwingungen), 1334 (s), 1056 (s), 799 (s, Deformationsschwingung in Aromaten). |
|
Elementaranalyse: |
||||
|
C13H12N2O x 0.25 H2O (212.3 + 4.5 = 216.8) |
||||
|
Ber. (%) : Gef. (%) : |
C 72.04 C 72.30 |
H 5.81 H 5.70 |
N 12.92 N 12.92 |
|
|
2.4.1.3
|
Herstellung von 4-Nitro-2,6-bis(4-pyridyl)phenol 49 |
|
Zu 4.40 g (20.80 mmol) 1,3-Bis-(4-pyridyl)-propan-2-on 47 und 3.40 g (20.80 mmol) Natrium-nitromalonaldehyd-monohydrat 35 in 30 ml Ethanol gibt man eine Lösung von 1.60 g Natriumhydroxid in 40 ml Wasser. Man läßt 3 d bei Raumtemperatur rühren, wobei ein orangefarbener Niederschlag entsteht. Das Ethanol wird im Rotationsverdampfer abdestilliert und der Rückstand mit 30 proz. Essigsäure neutralisiert. Der Niederschlag wird abfiltriert und mehrmals mit Wasser gewaschen. Schließlich wird eine Heißextraktion mit 70 ml Ethanol durchgeführt. Man erhält 5.10 g (16.12 mmol, 81 %) 49 in Form orangefarbener Nadeln mit einem Schmelzpunkt von 310 °C. |
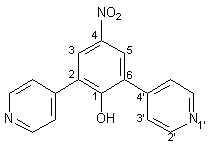
|
1 H-NMR (300 MHz, [d6]DMSO): |
|
|
|
3.44 (m, 1H, H/D-Austausch des Phenol-H mit [d6]DMSO), 7.86 (d, 4H, 3J3‘,2‘ = 6.3 Hz, 3‘-H), 8.19 (s, 2H, 3-H, 5-H), 8.76 (d, 4H, 3J2‘,3‘ = 6.3 Hz, 2‘-H). |
|
13 C-NMR (75 MHz, [d6]DMSO): |
|
|
|
123.7, 127.1, 147.8, 148.1 (Aromaten- und Heteroaromaten-H). Von den sieben erwarteten Signalen sind aufgrund schlechter Löslichkeit und Überlagerung nur vier Signale zu erkennen. |
|
MS (FD): |
|
|
m/z (%) = |
293 (100) [M+]. |
|
IR(KBr): |
|
|
|
3386 (m, OH), 3086 (s, C-H-aromatische Schwingungen), 1598(s, C=C-aromatische Schwingungen), 1332 (s, NO2), 1279 (s), 1115 (s, Phenol), 840 (s) und 747 (s, Deformationsschwingung in Aromaten). |
|
Elementaranalyse: |
||||
|
C16H11N3O3 x 2 H2O (293.3 + 36.0 = 329.3) |
||||
|
Ber. (%) : Gef. (%) : |
C 58.36 C 58.79 |
H 4.59 H 4.66 |
N 12.76 N 12.64 |
|
|
2.4.1.4
|
Herstellung von 4-Amino-2,6-bis(4-pyridyl)phenol 50 |
|
0.30 g (1.00 mmol) 4-Nitro-2,6-bis(4-pyridyl)phenol 49 werden in 150 ml Methanol suspendiert und ca. 200 mg Palladium/Aktivkohle-Katalysator werden hinzugegeben. Die Reaktionslösung wird dann in einer Hydrierapparatur 2 d bei Raumtemperatur und Normaldruck mit H2 umgesetzt (Wasserstoffaufnahme ca. 80 ml). Die entstandene, bernsteinfarbene Lösung wurde unter Stickstoff über eine Umkehrfritte abfiltriert und das Lösungsmittel wurde bei Raumtemperatur im Ölpumpenvakuum abdestilliert. Nach Trocknen im Ölpumpenvakuum erhält man 0.27 g (100 %) 50 in Form eines hellbraunen Feststoffs, welcher sofort weiter eingesetzt wird. Da sich die Verbindung an der Luft zersetzt, wurde keine Analytik durchgeführt. |
|
2.4.2
|
Synthese von 4-(2,4,6-Triphenyl-1-pyridinio)-2,6-bis(4-pyridyl)phenolat 17 |
|
0.27 g (1.00 mmol) frisch hergestelltes 4-Amino-2,6-bis(2-pyridyl)phenol 50 werden in 40 ml trockenem Methanol gelöst. Dazu gibt man 0.33 g (4.00 mmol) wasserfreies Natriumacetat und 0.40 g (1.00 mmol) 2,4,6-Triphenylpyrylium-tetrafluorborat 38. Diese Mischung wird im Wasserbad 3 h unter Rückfluß erhitzt. 0.22 g (4.00 mmol) Natriummethanolat werden zugegeben und es wird weitere 10 min. unter Rückfluß erhitzt. Dann wird die heiße Lösung in 100 ml 10 proz. wäßrige NaOH-Lösung gegeben. Es bildet sich ein dunkelroter Niederschlag, der nach 24 h abfiltriert wird. Der Niederschlag wird mit wenig Wasser und dreimal mit je 50 ml Diethylether gewaschen. Zur Reinigung wird der erhaltene Feststoff einer Heißextraktion mit 50 ml Wasser/Methanol (3:1) unterzogen. Nach dem Trocknen über P4O10 erhält man 0.47 g (0.85 mmol; 85 %) 17 in Form rostroter Kristalle mit einem Schmelzpunkt von 220 °C. |
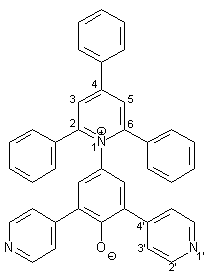
|
1 H-NMR (300 MHz, CDCl3): |
|
|
|
6.42 (s, 2H, 3-H und 5-H des Phenolatrings), 7.25-7.67 (m, 15H, Aromaten-H der 2,4,6-Phenylreste), 7.91 (d, 4H, 3J3‘,2‘ = 5.8 Hz, 3‘-H), 8.13 (s, 2H, 3-H und 5-H des Pyridiniumrings), 8.32 (d, 4H, 3J2‘,3‘ = 5.8 Hz, 2‘-H). |
|
13 C-NMR (75 MHz, CDCl3): |
|
|
|
123.1, 123.2, 128.7, 129.0, 129.2, 148.7, 148.8 (Aromaten- und Heteroaromaten-H). Von den 18 erwarteten Signalen sind aufgrund schlechter Löslichkeit und Überlagerung nur sieben Signale zu erkennen. |
|
MS (APCI, positiv): |
|
|
m/z = |
554 [M++1]. |
|
IR(KBr): |
|
|
|
3430 (w, OH), 3057 (s, C-H-aromatische Schwingungen), 1618 (s, H2O), 1596(s) und 1474(m, C=C-aromatische Schwingungen), 1444 (s), 1326 (s), 1255 (s), 841 (s), 769 (s) und 696 (s, Deformationsschwingung in Aromaten). |
|
UV/Vis (CH3CN): |
|
|
l
max (log |
571 nm (3.670), 432 nm (4.159), 301 nm (4.622), 239 nm (4.599). |
|
Elementaranalyse: |
||||
|
C39H27N3O x 3 H2O (553.7 + 54.0 = 607.7) |
||||
|
Ber. (%) : Gef. (%) : |
C 75.96 C 75.66 |
H 5.56 H 5.06 |
N 6.81 N 6.79 |
|
|
2.4.3
|
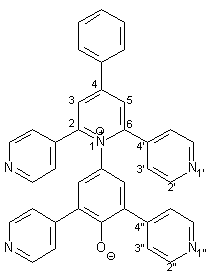
Synthese von 4-[4-Phenyl-2,6-bis(4-pyridyl)-1-pyridinio]- 2,6-bis(4-pyridyl)-phenolat 18 |
|
Die Herstellung des Betains 18 entspricht der Synthese von 17 (s. 2.4.2). 0.27 g (1.00 mmol) frisch hergestelltes 4-Amino-2,6-bis(2-pyridyl)phenol 50 werden in 40 ml trockenem Methanol gelöst. Dazu gibt man 0.33 g (4.00 mmol) wasserfreies Natriumacetat und 0.57 g (1.00 mmol) Pyrylium- salz 51, das nach einer Vorschrift von Che[12] hergestellt wurde. Diese Mischung wird im Wasserbad 3 h unter Rückfluß erhitzt. |
|
0.22 g (4.00 mmol) Natriummethanolat werden zugegeben und es wird weitere 10 min. unter Rückfluß erhitzt. Nach Aufarbeitung und Reinigung erhält man 0.46 g (0.83 mmol; 83%) 18 in Form violetter Kristalle mit einem Schmelzpunkt von 344 °C. |
|
1 H-NMR (300 MHz, [d6]-DMSO): |
|
|
|
7.15 (s, 2H, 3-H und 5-H des Phenolatrings), 7.52-7.69 (m, 13H, Aromaten-H des 4-Phenylrestes, 3‘-H, 3‘‘-H), 8.16 (d, 4H, 3J2‘‘,3‘‘ =5.8 Hz, 2‘‘-H), 8.68 (d, 4H, 3J2‘,3‘ =5.8 Hz, 2‘-H), 8.74 (s, 2H, 3-H und 5-H des Pyridiniumrings). |
|
13 C-NMR (75 MHz, [d6]-DMSO): |
|
|
|
122.4, 124.0, 148.7, 149.8 (Aromaten- und Heteroaromaten-C). Von den 17 erwarteten Signalen sind aufgrund schlechter Löslichkeit und Überlagerung nur vier Signale zu erkennen. |
|
MS (APCI, positiv): |
|
|
m/z = |
555 [M+], 556 [M++1]. |
|
IR(KBr): |
|
|
|
3415 (w, OH), 3044 (s, C-H-aromatische Schwingungen), 1623 (s, H2O), 1593 (s) und 1480 (m, C=C-aromatische Schwingungen), 1407 (s), 1261 (s), 842 (s), 817 (s), 700 (s, Deformationsschwingung in Aromaten). |
|
UV/Vis (CH3CN): |
|
|
l
max (log |
597 nm (3.565), 435 nm (3.891), 305 nm (4.354), 234 nm (4.399). |
|
Elementaranalyse: |
||||
|
C37H25N5O x 3.5 H2O (555.6 + 63.1 = 618.7) |
||||
|
Ber. (%) : Gef. (%) : |
C 71.83 C 71.53 |
H 5.21 H 4.91 |
N 11.32 N 10.94 |
|
|
2.4.4
|
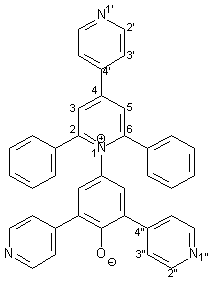
Synthese von 4-[2,6-Diphenyl-4-(4-pyridyl)-1-pyridinio]-2,6-bis(4-pyridyl)- phenolat 19 |
|
Die Herstellung des Betainfarbstoffes 19 entspricht der Synthese von 17 (s. 2.4.2). 0.27 g (1.00 mmol) frisch hergestelltes 4-Amino-2,6-bis(2-pyridyl)phenol 50 werden in 40 ml trockenem Methanol gelöst. Dazu gibt man 0.33 g (4.00 mmol) wasserfreies Natriumacetat und 0.48 g (1.00 mmol) Pyryliumsalz 42, das nach einer Vorschrift von Che[12] hergestellt wurde. Diese Mischung wird im Wasserbad 3 h unter Rückfluß erhitzt. 0.22 g (4.00 mmol) Natriummethanolat werden zugegeben und es wird weitere 10 min. unter Rückfluß erhitzt. Nach Aufarbeitung und Reinigung erhält man 0.43 g (0.78 mmol; 78%) 19 in Form violetter Kristalle mit einem Schmelzpunkt von 350 - 352 °C. |
|
1 H-NMR (300 MHz, [d6]DMSO): |
|
|
|
7.05 (s, 2H, 3-H und 5-H des Phenolatrings), 7.40-7.58 (m, 14H, Aromaten-H der 2,6-Phenylreste, 3‘‘-H), 8.30 (m, 6H, 3‘-H, 2‘‘-H), 8.70 (s, 2H, 3-H und 5-H des Pyridiniumrings), 8.86 (s, 2H, 3J2‘,3‘ =6.2 Hz, 2‘-H). |
|
13 C-NMR (75 MHz, [d6]DMSO): |
|
|
|
122.5, 128.4, 129.8, 134.4, 148.3, 148.6, 151.1 (Aromaten- und Heteroaromaten-H). Von den 17 erwarteten Signalen sind aufgrund schlechter Löslichkeit und Überlagerung nur sieben Signale zu erkennen. |
|
MS (APCI, positiv): |
|
|
m/z = |
555 [M++1]. |
|
IR(KBr): |
|
|
|
3432 (w, OH), 3029 (s, C-H-aromatische Schwingungen), 1622 (s, H2O), 1595(s) und 1492(m, C=C-aromatische Schwingungen), 1410 (s), 1259 (s), 821 (s), 697 (s, Deformationsschwingung in Aromaten). |
|
UV/Vis (CH3CN): |
|
|
l
max (log |
603 nm (3.599), 433 nm (4.067), 250 nm (4.571). |
|
Elementaranalyse: |
||||
|
C38H26N4O x 3 H2O (554.7 + 54.0 = 608.7) |
||||
|
Ber. (%) : Gef. (%) : |
C 74.98 C 74.59 |
H 5.30 H 5.12 |
N 9.20 N 9.01 |
|
|
2.4.5
|
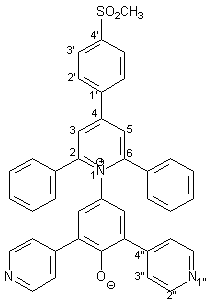
Synthese von 4-[2,6-Diphenyl-4-(4-methansulfonyl-phenyl)-1- pyridinio]-2,6-bis(4-pyridyl)phenolat 20 |
|
Die Herstellung des Betains 20 entspricht der Synthese des Betains 17 (s. 2.4.2). 0.27 g (1.00 mmol) frisch hergestelltes 4-Amino-2,6-bis(2-pyridyl)phenol 50 werden in 40 ml trockenem Methanol gelöst. Dazu gibt man 0.33 g (4.00 mmol) wasserfreies Natriumacetat und 0.47 g (1.00 mmol) 2,6-Diphenyl-4-(4-methansulfonyl-phenyl)-pyrylium-tetrafluorborat 26 (s. Kapitel 2.2.2.2). Diese Mischung wird im Wasserbad 3 h unter Rückfluß erhitzt. 0.22 g (4.00 mmol) Natriummethanolat werden zugegeben und es wird weitere 10 min. unter Rückfluß erhitzt. Nach der Aufarbeitung und Reinigung erhält man 0.49 g (0.78 mmol; 78%) 17 in Form violetter Kristalle mit einem Schmelzpunkt von 244 - 246 °C. |
|
1 H-NMR (300 MHz, CDCl3): |
|
|
|
3.16 (s, 3H, SO2CH3), 6.53 (s, 2H, 3-H und 5-H des Phenolatrings), 7.23-7.44 (m, 14H, Aromaten-H der 2,6-Phenylreste, 3‘‘-H), 8.09 (d, 2H, 3J2‘,3‘ = 8.5 Hz, 2‘-H), 8.15 (s, 2H, 3-H und 5-H des Pyridiniumrings), 8.23 (d, 2H, 3J3‘,2‘ = 8.5 Hz, 3‘-H), 8.35 (d, 4H, 3J2‘‘,3‘‘ = 6 Hz, 2‘‘-H). |
|
13 C-NMR (75 MHz, CDCl3): |
|
|
|
122.5, 128.1, 128.4, 129.8, 148.6 (Aromaten- und Heteroaromaten-H). Von den 21 erwarteten Signalen sind aufgrund schlechter Löslichkeit und Überlagerung nur fünf Signale zu erkennen. |
|
MS (APCI, positiv): |
|
|
m/z = |
632 [M++1]. |
|
IR(KBr): |
|
|
|
3425 (w, OH), 3060 (s, C-H-aromatische Schwingungen), 1622 (s, H2O), 1597 (s) und 1478 (m, C=C-aromatische Schwingungen), 1410 (s), 1304 (s), 1220 (s), 1091 (s, SO2), 837 (s), 771 (s) und 703 (s, Deformationsschwingung in Aromaten). |
|
UV/Vis (CH3CN): |
|
|
l
max (log |
602 nm (3.672), 433 nm (4.129), 287 nm (4.622), 240 nm (4.548). |
|
Elementaranalyse: |
||||
|
C40H29N3O3S x 3 H2O (631.7 + 54.0 = 685.8) |
||||
|
Ber. (%) : Gef. (%) : |
C 70.06 C 70.40 |
H 5.14 H 5.27 |
N 6.13 N 5.65 |
|
|
2.4.6
|
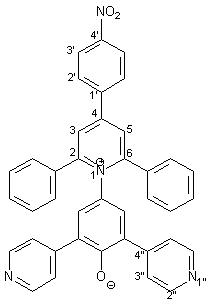
Synthese von 4-[2,6-Diphenyl-4-(4-nitrophenyl)-1-pyridinio]- 2,6-bis(4-pyridyl)phenolat 21 |
|
Die Herstellung des Betains 21 entspricht der Synthese des Betains 17 (s. Kapitel 2.4.2). 0.27 g (1.00 mmol) frisch hergestelltes 4-Amino-2,6-bis(2-pyridyl)phenol 50 werden in 40 ml trockenem Methanol gelöst. Dazu gibt man 0.33 g (4.00 mmol) wasserfreies Natriumacetat und 0.44 g (1.00 mmol) Pyryliumsalz 29, das nach einer Vorschrift von Gerson und Heilbronner[21] hergestellt wurde. Diese Mischung wird im Wasserbad 3 h unter Rückfluß erhitzt. 0.22 g (4.00 mmol) Natriummethanolat werden zugegeben und es wird weitere 10 min. unter Rückfluß erhitzt. Nach Aufarbeitung und Reinigung erhält man 0.48 g (0.80 mmol; 80%) 21 in Form olivgrüner Kristalle, die sich ab 260 °C zersetzen. |
|
1 H-NMR (300 MHz, [d6]DMSO): |
|
|
|
7.07 (s, 2H, 3-H und 5-H des Phenolatrings), 7.42-7.56 (m, 14H, Aromaten-H der 2,6-Phenylreste, 3‘‘-H), 8.30 (d, 4H, 3J2‘‘,3‘‘ = 6.1 Hz, 2‘‘-H), 8.43 (d, 2H, 3J2‘,3‘ = 9 Hz, 2‘-H), 8.59 (d, 2H, 3J3‘,2‘ = 9 Hz, 3‘-H), 8.69 (s, 2H, 3-H und 5-H des Pyridiniumrings). |
|
13 C-NMR (75 MHz, [d6]DMSO): |
|
|
|
122.5, 128.3, 129.8, 148.6 (Aromaten- und Heteroaromaten-H). Von den 18 erwarteten Signalen sind aufgrund schlechter Löslichkeit und Überlagerung nur vier Signale zu erkennen. |
|
MS (APCI, positiv): |
|
|
m/z = |
599 [M++1]. |
|
IR(KBr): |
|
|
|
3425 (w, OH), 3059 (s, C-H-aromatische Schwingungen), 1619 (s, H2O), 1595 (s) und 1452 (m, C=C-aromatische Schwingungen), 1411 (s), 1346 (s, NO2), 1256 (s), 857 (s), 769 (s) und 698 (s, Deformationsschwingung in Aromaten). |
|
UV/Vis (CH3CN): |
|
|
l
max (log |
616 nm (3.486), 433 nm (3.964), 294 nm (4.534), 241 nm (4.495). |
|
Elementaranalyse: |
||||
|
C39H26N4O3 x 2 H2O (598.7 + 36.0 = 634.7) |
||||
|
Ber. (%) : Gef. (%) : |
C 72.77 C 72.77 |
H 4.85 H 4.91 |
N 8.70 N 9.19 |
|
|