|
|
2.2
|
Synthese der 2-pyridyl-substituierten Pyridinium-N-phenolat-Betainfarbstoffe |
|
2.2.1
|
Versuche zur Synthese von 4-[4-Phenyl-2,6-bis(2-pyridyl)-1-pyridinio]-2,6-bis(2-pyridyl)phenolat 8 |
|
2.2.1.1
|
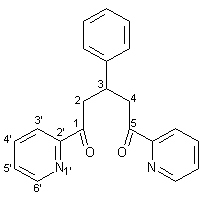
Herstellung von 1,5-(2-Pyridyl)-3-phenylpentan-1,5-dion 24 |
|
In einen 100 ml-Einhalsrundkolben werden bei 0 °C 0.15 g (6.00 mmol) Natriumhydrid zu 15 ml Methanol gegeben. Anschließend werden 4.85 g (40.00 mmol) 2-Acetylpyridin hinzugefügt und die Mischung wird stark gerührt. Bei einer Temperatur von 0 - 10 °C werden nun langsam 2.12 g (20.00 mmol) frisch destillierter Benzaldehyd zugetropft. Die Reaktionsmischung wird dann unter Rühren mit Wasser versetzt, bis man eine milchig trübe Suspension erhält. Nach vierstündigem Rühren setzt sich ein braunes Öl ab, das nach zwei Tagen bei +4 °C auskristallisiert. Der erhaltene Feststoff wird einmal aus 90 proz. Ethanol umkristallisiert. Man erhält 2.97 g (9.00 mmol; 45 %) 24 als weißen Feststoff mit einem Schmelzpunkt von 147 - 149 °C. |
|
1 H-NMR (300 MHz, CDCl3): |
|
|
|
3.59 - 3.81 (m, 4H, AB-Teil des ABX-Systems, 2/4-H), 4.16 (quin, 1H, X-Teil des ABX-Systems, 3J3,4 und 3J3,2 = 7.2 Hz, 3-H), 7.20 – 7.48 (m, 7H, Aromaten-H des 3-Phenylrestes und 5‘-H), 7.78 (m, 2H, 3‘-H), 7.95 (m, 2H, 4‘-H), 8.64 (m, 2H, 6‘-H). |
|
13 C-NMR (75 MHz, [d6]DMSO): |
|
|
|
36.1 (C-3), 44.1 (C-2, C-4), 121.8, 126.3, 127.0, 127.7, 128.8, 136.7, 144.6, 148.8, 153.4, (Aromaten- und Heteroaromaten-C), 200 (C-1, C-5). |
|
MS (EI): |
|
|
m/z (%) = |
330(8) [M+]. |
|
IR(KBr): |
|
|
|
3098 (s, C-H-aromatische Schwingungen), 1710 (s, C=O), 1583 (s) und 1464 (m, C=C-aromatische Schwingungen), 1434 (s), 1411 (s), 1354 (s), 1282 (s), 995 (s), 760 (s), 751 (s) und 703 (s, Deformationsschwingung in Aromaten). |
|
Elementaranalyse: |
||||
|
C21H18N2O2 x 0.25 H2O (330.4 + 4.5 = 334.9) |
||||
|
Ber. (%) : Gef. (%) : |
C 75.32 C 75.64 |
H 5.57 H 5.58 |
N 8.36 N 8.27 |
|
|
2.2.2
|
Synthese von 4-[2,6-Diphenyl-4-(4-methansulfonyl-phenyl)-1-pyridinio]- 2,6-bis(2-pyridyl)phenolat 10 |
|
2.2.2.1
|
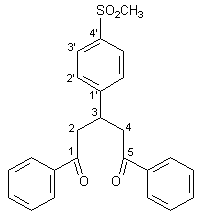
Herstellung von 1,5-Diphenyl-3-(4-methansulfonyl-phenyl)pentan-1,5-dion 25 |
|
Zu einer in einem 100 ml-Rundkolben befindlichen und auf 0 °C gekühlten Lösung von 2.00 g (0.05 mol) Natriumhydroxid in 20 ml Wasser und 10 ml Ethanol werden 9.61 g (0.08 mol) Acetophenon gegeben. Dann werden unter starken Rühren 7.38 g (0.04 mol) 4-Methansulfonyl-benzaldehyd zugegeben. Es bildet sich ein gelber, voluminöser Niederschlag. Nach 2 h rühren wird die Reaktionsmischung für 12 h bei +4 °C belassen. Der hellgelbe Niederschlag wird dann abfiltriert, mit Wasser neutral und abschließend mit wenig, auf 0 °C gekühltem, Ethanol gewaschen. Nach dem Trocknen an der Luft wird das Produkt aus 150 ml 95 proz. Ethanol umkristalliert. Man erhält 10.73 g (26.00 mmol; 66 %) 25 in Form farbloser Kristalle mit einem Schmelzpunkt von 200 – 202 °C. |
|
1 H-NMR (300 MHz, CDCl3): |
|
|
|
2.99 (s, 3H, SO2CH3), 3.34 - 3.55 (m, 4H, AB-Teil des ABX-Systems, 2-H, 4-H), 4.15 (quin, 1H, X-Teil des ABX-Systems, 3J3,4 und 3J3,2 = 6.8 Hz, 3-H), 7.41 – 7.57 (m, 10H, Aromaten-H der 1,5-Phenylreste), 7.85 (d, 2H, |
|
13 C-NMR (75 MHz, CDCl3): |
|
|
|
36.7 (C-3), 44.2 und 44.5 (C-2, C-4, SO2CH3), 127.7, 128.0, 128.6, 128.7, 133.4, 136.6, 138.6, 150.5 (Aromaten-H), 197.6 (C=O). |
|
MS (EI): |
|
|
m/z (%) = |
406 (5) [M+], 287 (68) [C6H5-CO-CH2-CH-C6H4-SO2CH3], 105 (100) |
|
IR(KBr): |
|
|
|
3065 (s, C-H-aromatische Schwingungen), 1681 (s, C=O), 1596 und 1449 (m, C=C-aromatische Schwingungen), 1294 (s) und 1152 (s, SO2), 752 (s) und 690 (s, Deformationsschwingung in Aromaten). |
|
Elementaranalyse: |
||||
|
C24H22O4S (406.5) |
||||
|
Ber. (%) : Gef. (%) : |
C 70.91 C 70.45 |
H 5.46 H 5.51 |
||
|
2.2.2.2
|
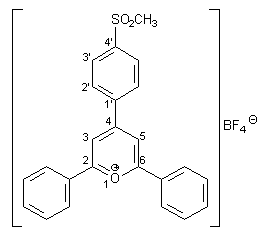
Herstellung von 2,6-Diphenyl-4-(4-methansulfonyl-phenyl)pyrylium-tetrafluorborat 26 |
|
6.09 g (15.00 mmol) 1,5-Diphenyl-3-(4-methansulfonyl-phenyl)pentan-1,5-dion 25 und 3.12 g (15.00 mmol) Benzalacetophenon werden in 10 ml wasserfreier Essigsäure gelöst und 20 ml Bortrifluorid-Diethyletherat (Gehalt an BF3: 40 %) zugetropft. Man erhält eine rote Lösung, die 6 h unter Rückfluß erhitzt wird. Zu der Mischung werden nach dem Abkühlen 50 ml Diethylether gegeben. Der entstehende gelbe Niederschlag wird abfiltriert und aus Essigsäure umkristallisiert. Zur weiteren Reinigung wird das Produkt mit Acetonitril heißextrahiert. Man erhält 5.05 g (0.11 mmol; 71 %) 26 in Form gelber Kristalle mit einem Schmelzpunkt von 138 - 140 °C. |
|
1 H-NMR (300 MHz, [d6]DMSO): |
|
|
|
3.34 (s, 3H, SO2CH3), 7.48 – 7.84 (m, 10H, Aromaten-H des 4-Phenylrestes), 8.26 (d, 2H, 3J2‘,3‘ = 8.4 Hz, 2‘-H), 8.75 (d, 2H, 3J3‘,2‘ = 8.4 Hz, 3‘-H), 9.20 (s, 2H, 3-H und 5-H). |
|
13 C-NMR (75 MHz, [d6]DMSO): |
|
|
|
128.7, 129.6, 130.4 (Aromaten-H). Von den 12 erwarteten Signalen sind aufgrund schlechter Löslichkeit und Überlagerung nur drei Signale zu erkennen. |
|
MS (APCI, positiv): |
|
|
m/z = |
387 [M+ - BF4-]. |
|
IR(KBr): |
|
|
|
3441 (w, OH), 3035 (s, C-H-aromatische Schwingungen), 1625 (s, H2O), 1597 (s) und 1497 (s, C=C-aromatische Schwingungen), 1310 (s) und 1052 (s, SO2), 782 (s), 768 (s) und 683 (s, Deformationsschwingung in Aromaten). |
|
Elementaranalyse: |
||||
|
C24H19BF4O3S x 3 H2O (474.3 + 54.0 = 528.3) |
||||
|
Ber. (%) : Gef. (%) : |
C 54.56 C 54.90 |
H 4.77 H 4.28 |
||
|
2.2.2.3
|
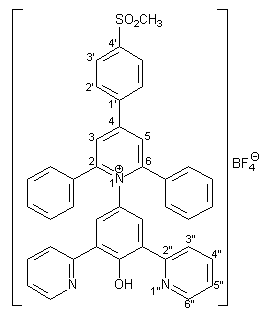
Herstellung von 2,6-Diphenyl-4-(4-methansulfonylphenyl)-1- [4-hydroxy-3,5-bis(2-pyridyl)phenyl]pyridinium-tertrafluorborat 28 |
|
1.34 g (5.00 mmol) frisch hergestelltes 4-Amino-2,6-bis(2-pyridyl)phenol 27[13] werden in 40 ml trockenem Methanol gelöst. Dazu werden 1.65 g (20.00 mmol) wasserfreies Natriumacetat und 2.37 g (5.00 mmol) 2,6-Diphenyl-4-(4-methansulfonyl-phenyl)pyrylium-tetrafluorborat 26 gegeben. Die Reaktionsmischung wird im Wasserbad 3 h unter Rückfluß erhitzt. Die heiße, dunkelrote Lösung wird dann mit 30 ml Wasser versetzt. Dabei fällt ein gelber Feststoff aus. Man läßt über Nacht rühren, der gelbe Niederschlag wird abfiltriert, mit wenig Wasser und viel Diethylether gewaschen und im Ölpumpenvakuum getrocknet. Man erhält 3.13 g (4.35 mmol; 87%) 28 in Form gelber Kristalle mit einem Schmelzpunkt von 137 – 139 °C. |
|
1 H-NMR (300 MHz, CDCl3): |
|
|
|
3.04 (s, 3H, SO2CH3), 7.15-7.52 (m, 12H, Aromaten-H der 2,6-Phenylreste, 3-H und 5-H des Phenolrings), 7.69-7.79 (m, 4H, 2‘-H, 5‘‘-H), 7.86 (m, 2H, 3‘‘-H), 7.95 (d, 2H, 3J3‘,2‘ = 8.2 Hz, 3‘-H) 8.03- 8.07 (m, 4H, 3-H und 5-H des Pyridiniumrings, 4‘‘-H), 8.43 (m, 2H, 6‘‘-H). Das Phenol-H wird nicht beobachtet. |
|
13 C-NMR (75 MHz, CDCl3): |
|
|
|
44.2 (SO2CH3), 122.5, 127.1, 127.7, 128.1, 128.6, 128.7, 129.5, 130.4, 132.8, 133.4, 158.0, 159.7 (Aromaten- und Heteroaromaten-H). Von den 21 erwarteten Signalen sind aufgrund der schlechten Löslichkeit und Überlagerung nur 13 Signale zu erkennen. |
|
MS (APCI, positiv): |
|
|
m/z = |
632 [M+]. |
|
IR(KBr): |
|
|
|
3434 (w, OH), 3058 (s, C-H-aromatische Schwingungen), 1624 (s, H2O), 1597 (s) und 1452 (m, C=C-aromatische Schwingungen), 1419 (s, SO2-Valenz), 1310 (s), 1154 (s, SO2-Valenz), 1069 (s, BF4-), 755 (s) und 693 (s, Deformationsschwingung in Aromaten). |
|
UV/Vis (CH3CN): |
|
|
l
max (log |
294 nm (4.548), 236 nm (4.610). |
|
Elementaranalyse: |
||||
|
C40H30BF4N3O3S x 1.5 H2O (719.6 + 27.0 = 746.6) |
||||
|
Ber. (%) : Gef. (%) : |
C 64.35 C 64.15 |
H 4.46 H 4.24 |
N 5.63 N 5.45 |
|
|
2.2.2.4
|
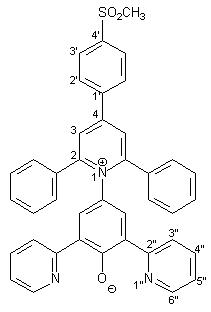
Herstellung von 4-[2,6-Diphenyl-4-(4-methansulfonyl-phenyl)-1-pyridinio]- 2,6-bis(2-pyridyl)phenolat 10 |
|
0.72 g (1.00 mmol) Pyridiniumsalz 28 und 0.22 g (4.00 mmol) Natriummethanolat werden in 30 ml wasserfreiem Methanol 10 min. unter Rückfluß erhitzt. Die heiße Lösung wird dann in 100 ml einer 10 proz. wäßrigen Natriumhydroxidlösung gegeben. Es bildet sich ein violetter Niederschlag, der nach 24 h abfiltriert wird. Der Niederschlag wird mit wenig Wasser und dreimal mit je 50 ml Diethylether gewaschen. Zur Reinigung wird der Feststoff zweimal einer Heißextraktion mit je 40 ml Wasser/Methanol (2:1) unterzogen. Nach dem Trocknen über Diphosphorpentoxid erhält man 0.53 g (0.83 mmol; 83%) 10 in Form dunkelgrüner Kristalle mit einem Schmelzpunkt von 224-226 °C. |
|
1 H-NMR (300 MHz, [d6]DMSO): |
|
|
|
3.33 (s, 3H, SO2CH3), 6.99 (m, 2H, 5‘‘-H), 7.29-7.61 (m, 12H, Aromaten-H der 2,6-Phenylreste, 3‘‘-H), 7.83 (s, 2H, 3-H und 5-H des Phenolatrings), 8.15 (d, 2H, 3J2‘,3‘ = 8.4 Hz, 2‘-H), 8.38 (m, 2H, 4‘‘-H), 8.54 (d, 2H, 3J3‘,2‘ = 8.4 Hz, 3‘-H), 8.58 (s, 2H, 3-H und 5-H des Pyridiniumrings), 8.94 (m, 2H, 6‘‘-H). |
|
13 C-NMR (75 MHz, [d6]DMSO): |
|
|
|
128.0, 128.2, 129.9 (Aromaten- und Heteroaromaten-H). Von den 20 erwarteten Signalen sind aufgrund schlechter Löslichkeit und Überlagerung nur drei Signale zu erkennen. |
|
MS (APCI, positiv): |
|
|
m/z = |
632 [M++1]. |
|
IR(KBr): |
|
|
|
3402 (w, OH), 3056 (s, C-H-aromatische Schwingungen), 1619 (s, H2O), |
|
UV/Vis (CH3CN): |
|
|
l
max (log |
609 nm (3.352), 438 nm (4.013), 286 nm (4.529), 242 nm (4.644). |
|
Elementaranalyse: |
||||
|
C40H29N3O3S x 3 H2O (631.7 + 54.0 = 685.8) |
||||
|
Ber. (%) : Gef. (%) : |
C 70.06 C 69.86 |
H 5.14 H 4.98 |
N 6.13 N 5.79 |
|
|
2.2.3
|
Synthese von 4-[2,6-Diphenyl-4-(4-nitrophenyl)-1-pyridinio]-2,6-bis- (2-pyridyl)phenolat 11 |
|
2.2.3.1
|
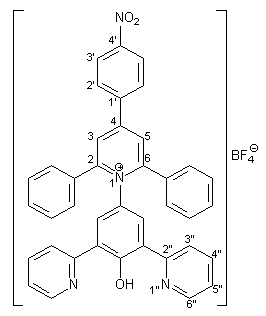
Herstellung von 2,6-Diphenyl-4-(4-nitrophenyl)-1-[4-hydroxy-3,5-bis- (2-pyridyl)phenyl]pyridinium-tetrafluorborat 30 |
|
Die Herstellung von 30 erfolgt analog zur Synthese von 28 (s. 2.2.2.1). Es werden 1.34 g (5.00 mmol) frisch hergestelltes 4-Amino-2,6-bis(2-pyridyl)phenol 27[13], 2.21 g (5.00 mmol) Pyryliumsalz 29, das nach einer Vorschrift von Gerson und Heilbronner[21] hergestellt wurde, und 1.65 g (20.00 mmol) wasserfreies Natriumacetat in 40 ml trockenen Methanol umgesetzt. Nach der Aufarbeitung erhält man 3.02 g (4.40 mmol; 88%) des Pyridiniumsalzes 30 in Form gelber Kristalle mit einem Schmelzpunkt von 175 - 177 °C. |
|
1 H-NMR (300 MHz, [d6]DMSO): |
|
|
|
7.30-7.57 (m, 12H, Aromaten-H der 2,6-Phenylreste, 5‘‘-H), 7.83-8.00 (m, 4H, 3‘‘-H, 4‘‘-H), 8.16 (s, 2H, 3-H und 5-H am Phenolring),8.47 (d, 2H, 3J2‘,3‘ = 8.6 Hz, 2‘-H), 8.60-8.65 (m, 4H, 3‘-H, 6‘‘-H), 8.83 (s, 2H, 3-H und 5-H im Pyridiniumring). Das Phenol-H wird nicht beobachtet. |
|
13 C-NMR (75 MHz, [d6]DMSO): |
|
|
|
122.2, 128.3, 129.8 (Aromaten- und Heteroaromaten-H). Von den 20 erwarteten Signalen sind aufgrund schlechter Löslichkeit und Überlagerung nur drei Signale zu erkennen. |
|
MS (APCI, positiv): |
|
|
m/z = |
599 [M+]. |
|
IR(KBr): |
|
|
|
3430 (w, OH), 3066 (s, C-H-aromatische Schwingungen), 1621 (s, H2O), |
|
UV/Vis (CH3CN): |
|
|
l
max (log |
297 nm (4.621), 236 nm (4.559). |
|
Elementaranalyse: |
||||
|
C39H27BF4N4O3 x 3 H2O (686.5 + 54.0 = 740.5) |
||||
|
Ber. (%) : Gef. (%) : |
C 63.26 C 63.52 |
H 4.49 H 4.37 |
N 7.57 N 7.26 |
|
|
2.2.3.2
|
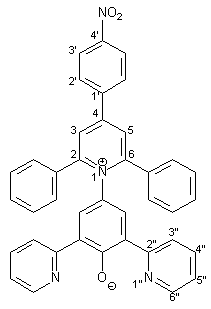
Herstellung von 4-[2,6-Diphenyl-4-(4-nitrophenyl)-1-pyridinio]-2,6-bis- (2-pyridyl)phenolat 11 |
|
Die Synthese des Betainfarbstoffs 11 entspricht in Ansatzgröße und Durchführung der Synthese des Betainfarbstoffs 10 (s. Kapitel 2.2.2.4). Es werden 0.87 g (1.00 mmol) des Pyridiniumsalzes 30 und 0.22 g (4.00 mmol) Natriummethanolat in 30 ml wasserfreiem Methanol umgesetzt. Man erhält 0.48 g (0.80 mmol; 80%) 11 in Form dunkelgrüner Kristalle mit einem Schmelzpunkt von 224 - 226 °C. |
|
1 H-NMR (300 MHz, [d6]DMSO): |
|
|
|
6.90 (m, 2H, 3‘‘-H), 7.20-7.47 (m, 12H, Aromaten-H der 2,6-Phenylreste, 5‘‘-H), 7.74 (s, 2H, 3-H und 5-H des Phenolatrings), 8.26-8.34 (m, 4H, 2‘-H, 4‘‘-H), 8.45 (d, 2H, 3J3‘,2‘ = 8.7 Hz, 3‘-H), 8.50 (s, 2H, 3-H und 5-H des Pyridiniumrings), 8.85 (m, 2H, 6‘‘-H). |
|
13 C-NMR (75 MHz, [d6]DMSO): |
|
|
|
123.1, 124.4, 128.2, 129.9, 148.0, 177.9 (Aromaten- und Heteroaromaten-H). Von den 20 erwarteten Signalen sind aufgrund schlechter Löslichkeit und Überlagerung nur vier Signale zu erkennen. |
|
MS (APCI, positiv): |
|
|
m/z = |
599 [M++1]. |
|
IR(KBr): |
|
|
|
3423 (w, OH), 3051 (s, C-H-aromatische Schwingungen), 1620 (s, H2O), |
|
UV/Vis (CH3CN): |
|
|
l
max (log |
622 nm (3.504), 438 nm (4.178), 294 nm (4.625), 243 nm (4.621). |
|
Elementaranalyse: |
||||
|
C39H26N4O3 x 2.5 H2O (598.7 + 45.0 = 643.7) |
||||
|
Ber. (%) : Gef. (%) : |
C 72.77 C 73.18 |
H 4.85 H 4.77 |
N 8.70 N 8.52 |
|
|