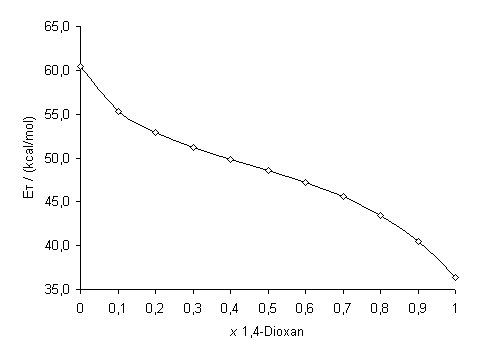|
|
1.5.3
|
UV/Vis-spektroskopische Untersuchung der Farbstoffe 13 und 14 in binären Wasser/1,4-Dioxan-Gemischen |
|
Die Untersuchung der Polarität binärer Lösungsmittelgemische ist ein interessantes und weites Forschungsgebiet. So untersuchten Dimroth und Reichardt[46] bereits 1966 verschiedene binäre Lösungsmittelgemische. Eine Zusammenstellung der Lösungsmittel-gemische, die bis 1994 untersucht worden sind, findet sich in Lit.[5]. Die Untersuchungen zeigten interessante Effekte. Für die meisten Lösungsmittelgemische erhält man eine monotone Änderung der ET(30)-Werte bei steigender Zugabe eines Lösungsmittels zu einem anderen. Diese Änderung verläuft in den wenigsten Fällen linear. Meistens führt die Zugabe von geringen Mengen eines polaren Lösungsmittels zu einem unpolaren Lösungsmittel zu einer großen hypsochromen Bandenverschiebung. Dieser Effekt kann mit einer bevorzugten Solvatation erklärt werden. Das zugegebene polare Lösungsmittel lagert sich dabei in einem stärkeren Maße an die gelösten Betainmoleküle an, als es durchschnittlich im Lösungsmittelgemisch vorhanden ist. Es bildet sich eine Solvathülle aus. Typische Beispiele für den Effekt einer bevorzugten Solvatation sind die binären Lösungsmittelgemische 1,4-Dioxan/Wasser[46], [47], [48], [49], [50] und Pyridin/Wasser[46]. Eine wichtige Anwendung ist der Nachweis von Wasser in organischen Lösungsmitteln[51], für die der Standardbetainfarbstoff 1 ebenfalls eingesetzt werden kann. Man nutzt dabei den Effekt der bevorzugten Solvatation aus. Schon geringste Spuren von Wasser in organischen Lösungsmitteln führen zu einer großen hypsochromen Verschiebung der längstwelligen Absorptionsbande. Weiterhin wurden solche Lösungsmittelgemische untersucht, bei denen das Gemisch zweier Lösungsmittel eine erhöhte Polarität im Vergleich zu den reinen Lösungsmittel zeigt. Diese Steigerung der Polarität läßt sich bei einigen HBD- / Nicht-HBD-Lösungsmittelgemischen wie z. B. DMSO/Alkohol-Mischungen[52] beobachten. Man kann diesen Effekt mit spezifischen intermolekularen Lösungsmittel/Lösungsmittel- Wasserstoffbrückenbindungen erklären ( Diese Beispiele zeigen, daß die Untersuchung binärer Lösungsmittelgemische mit dem Standardbetainfarbstoff 1 ein interessantes Gebiet in der Erforschung von Lösungsmittelgemischen ist und durchaus Anwendungsmöglichkeiten in der analytischen Chemie bestehen. Die schlechte Löslichkeit des Betainfarbstoffes 1 in Wasser machte es allerdings problematisch, binäre Lösungsmittelgemische der Art Lösungsmittel/Wasser zu untersuchen. Ist der Wassergehalt in dem Lösungsmittelgemisch zu hoch, löst sich das ET(30)-Betain nicht mehr. Untersuchungen von solchen Gemischen waren deshalb bisher nicht zufriedenstellend möglich. In den vorherigen UV/Vis-spektroskopischen Untersuchungen zeigten die neuen Betainfarbstoffe 13 und 14 eine hervorragende Löslichkeit in Wasser. Anhand eines ausgewählten binären Lösungsmittelgemisches sollte deshalb untersucht werden, ob sich die Farbstoffe 13 und 14 für diese Messungen eignen. Dazu wurde das Lösungsmittelgemisch 1,4-Dioxan/Wasser ausgewählt. Die beiden Lösungsmittel sind unbegrenzt zueinander löslich. Die Unterschiede in der Lage der Absorptionsmaxima zwischen dem unpolaren 1,4-Dioxan und Wasser ( |
|
Molenbruch Dioxan/Wasser |
für 13 |
ET(13)-Werte in kcal/mol |
für 14 |
ET(13)-Werte in kcal/mol |
|
0:10 |
460 |
62.2 |
473 |
60.4 |
|
1:9 |
493 |
58.0 |
520 |
55.0 |
|
2:8 |
515 |
55.5 |
541 |
52.8 |
|
3:7 |
530 |
53.9 |
559 |
51.1 |
|
4:6 |
543 |
52.7 |
573 |
49.9 |
|
5:5 |
558 |
51.2 |
589 |
48.5 |
|
6:4 |
573 |
49.9 |
605 |
47.3 |
|
7:3 |
594 |
48.1 |
627 |
45.6 |
|
8:2 |
619 |
46.2 |
657 |
43.5 |
|
9:1 |
674 |
42.4 |
707 |
40.4 |
|
10:0 |
761 |
37.6 |
787 |
36.3 |
|
Tabelle 23: |
Absorptionsmaxima und ET-Werte der Betaine 13 und 14, gemessen in dem binären Lösungsmittelgemisch Wasser/1,4-Dioxan. |
|
|
|
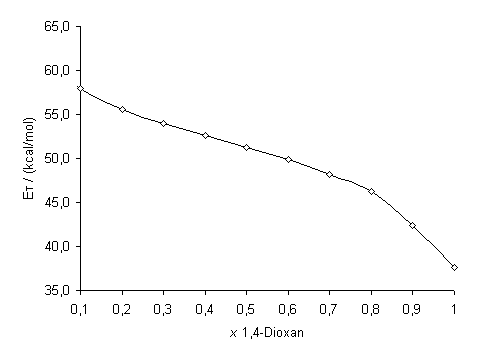
Abb. 24: |
Abhängigkeit der ET-Werte der Betaine 13 (oben) und 14 (unten) von der Zusammensetzung eines binären 1,4-Dioxan/Wasser-Gemisches; x = Molenbruch 1,4-Dioxan |
|
Die Ergebnisse der Messungen zeigen deutlich den beschriebenen Effekt einer bevorzugten Solvatation. Bei den Farbstoffen 13 und 14 reichen schon geringe Zugaben des polaren (unpolaren) Lösungsmittels zu dem unpolaren (polaren) Lösungsmittel aus, um eine deutliche hypsochrome (bathochrome) Verschiebung der längstwelligen Absorptionsbande hervorzurufen. Schon bei Zugabe von nur einem Mol Wasser zu neun Mol Dioxan verschiebt sich die Absorptionsbande um 86 nm ( Wie man aus diesen Werten erkennen kann, ergibt die Zugabe geringer Mengen eines polaren Lösungsmittels zu einem unpolaren Lösungsmittel in etwa die gleiche energetische Änderung wie die Zugabe einer geringen Menge eines unpolaren Lösungsmittels zu einem polaren. Der Farbstoff bildet eine Solvathülle mit dem Lösungsmittel, welches in der Lösung im Unterschuß vorhanden ist. Im mittleren Verlauf des Graphen geht die Kurve in eine Gerade über. Man kann dann von einer gleichgewichteten Solvatation des Betainfarbstoffes durch beide Lösungsmittel reden. Dieses exemplarische Beispiel zeigt, daß die neuen Farbstoffe 13 und 14 auch zur Untersuchung von binären Lösungsmitteln geeignet sind, besonders wenn es sich bei der einen Lösungsmittel- komponente um Wasser handelt. |
|