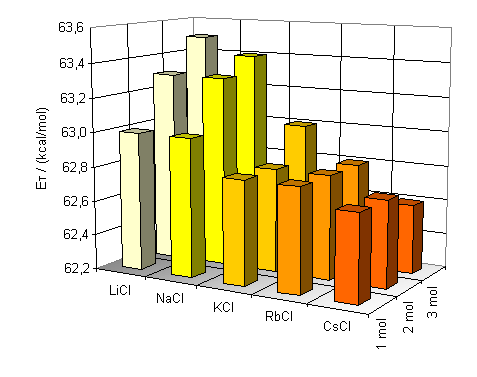|
|
1.5.2
|
UV/Vis-spektroskopische Untersuchung der halochromen Farbstoffe 13 und 14 in wäßrigen Ionophorlösungen |
|
Die Polarität verschiedenster reiner Lösungsmittel wurde durch empirische Parameter wie die ET(30)-Werte eingehend untersucht[9]. Allerdings sind entsprechende Untersuchungen für Elektrolytlösungen kaum bekannt[37],[38],[39],[40]. Mit dem wasserlöslichen methansulfonylsubstituierten Betain 3b[11] und dem carboxylatsubstituierten Betain 2[10] wurde bereits die echte Halochromie wäßriger Elektrolytlösungen untersucht. Als Halochromie bezeichnet man bisher, einem Vorschlag von Baeyer und Villiger[41] folgend, den pH-abhängigen Farbwechsel eines gelösten Farbstoffs bei Zusatz von Säure oder Base, das heißt eine chemische Umsetzung. Im Gegensatz zu dieser "trivialen" Halochromie möchten wir einer in Lit.[10] vorgeschlagenen Definition folgend den Begriff der echten Halochromie verwenden. Bei Verbindungen mit echter Halochromie erfolgt eine Farbänderung lediglich durch einen Ionophorzusatz zu einer Farbstofflösung, das heißt, es tritt keine grundlegende chemische Veränderung des Chromophors auf. Die Untersuchungen mit den Farbstoffen 3a und 2 führten zu dem Ergebnis, daß bei Zugabe von Ionophoren eine hypsochrome Verschiebung der längstwelligen UV/Vis-Absorptionsbande zu beobachten ist. Wäßrige Elektrolytlösungen scheinen also eine erhöhte Polartiät zu besitzen. Dabei wurden allerdings nur einmolare wäßrige Ionophorlösungen untersucht. Die Untersuchung höher konzentrierter Salzlösungen ist nicht möglich, da die Löslichkeit von 3b und 2 mit zunehmender Salzkonzentration infolge eines Aussalzungseffekts stark abnimmt. Die für diese Dissertation hergestellten Farbstoffe sollten im wesentlichen dazu dienen, weitere und genauere Untersuchungen wäßriger Ionophorlösungen zu ermöglichen. Die
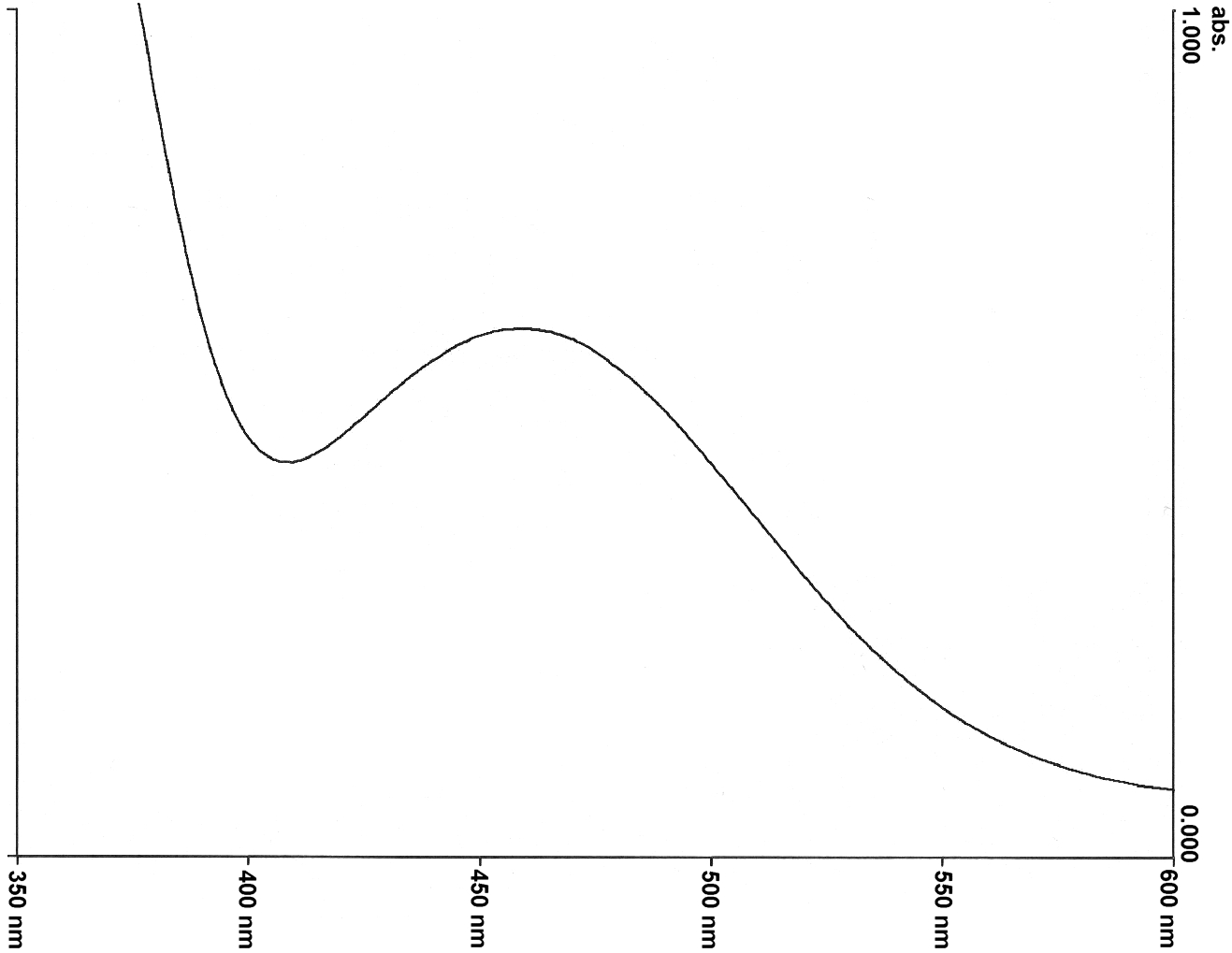
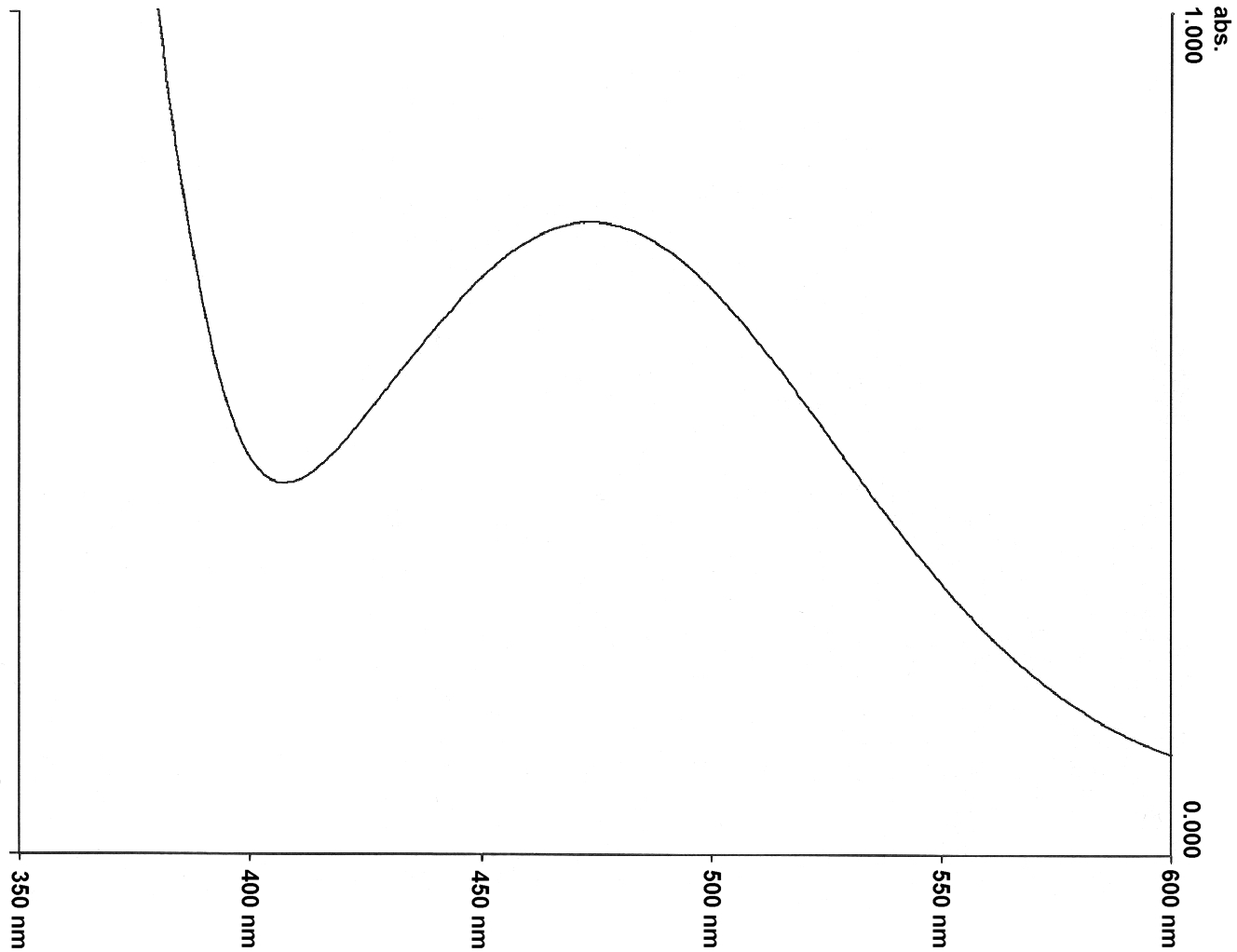
3-pyridylsubstituierten Farbstoffe 13 und 14 zeigten in den vorangegangenen Messungen die beste Wasserlöslichkeit und ein sehr ausgeprägtes Maximum der längstwelligen Absorptionsbande (Abb. 20). Für den Farbstoff 13 liegt das Maximum bei Um zu prüfen, in welchen Konzentrationen die Salzlösungen zur Messung dieser beiden Farbstoffe vorliegen dürfen, wurden zunächst ein-, zwei- und dreimolare Lösungen von Natriumchlorid hergestellt. Die Farbstoffe 13 und 14 lösten sich hervorragend in allen Lösungen, ohne daß ein Aussalzungseffekt zu beobachten war. Zunächst wurden deshalb die wäßrigen Lösungen von Alkalichloriden in verschiedenen Konzentrationen gemessen. Es wurden ein- , zwei- und dreimolare wäßrige Lösungen von Lithiumchlorid, Natriumchlorid Kaliumchlorid, Rubidiumchlorid und Cäsiumchlorid angesetzt und qualitative solvatochrome Messungen mit den Farbstoffen 13 und 14 durchgeführt. Die Ergebnisse sind in den Tabellen 17 und 18 aufgelistet und in Abb. 21 graphisch dargestellt. Anschließend wurden auch mit den gesättigten Lösungen dieser Salze UV/Vis-spektroskopische Messungen durchgeführt (gesättigte Lösungen bei 24 °C: |
|
|
ET(13)-Werte in kcal/mol |
|||||||
|
1 mol |
2 mol |
3 mol |
gesättigt |
1 mol |
2 mol |
3 mol |
gesättigt |
|
|
LiCl |
454 |
452 |
450 |
n. meß. |
63.0 |
63.3 |
63.5 |
- |
|
NaCl |
454 |
452 |
451 |
450 |
63.0 |
63.3 |
63.4 |
63.5 |
|
KCl |
455 |
455 |
454 |
453 |
62.8 |
62.8 |
63.0 |
63.1 |
|
RbCl |
455 |
455 |
455 |
455 |
62.8 |
62.8 |
62.8 |
62.8 |
|
CsCl |
456 |
456 |
457 |
460 |
62.7 |
62.7 |
62.6 |
62.2 |
|
Tabelle 17: |
Absorptionsmaxima und ET-Werte des Betains 13, gemessen in wäßrigen Alkalichloridlösungen unterschiedlicher Konzentration. |
|
|
ET(14)-Werte in kcal/mol |
|||||||
|
1 mol |
2 mol |
3 mol |
gesättigt |
1 mol |
2 mol |
3 mol |
gesättigt |
|
|
LiCl |
470 |
467 |
465 |
n. lösl. |
60.8 |
61.2 |
61.5 |
- |
|
NaCl |
471 |
468 |
466 |
463 |
60.7 |
61.1 |
61.4 |
61.8 |
|
KCl |
472 |
470 |
469 |
465 |
60.6 |
60.8 |
61.0 |
61.5 |
|
RbCl |
471 |
470 |
469 |
468 |
60.7 |
60.8 |
61.0 |
61.1 |
|
CsCl |
472 |
471 |
471 |
n. lösl. |
60.6 |
60.7 |
60.7 |
- |
|
Tabelle 18: |
Absorptionsmaxima und ET-Werte des Betains 14, gemessen in wäßrigen Alkalichloridlösungen unterschiedlicher Konzentration. |
|
|
|
Abb. 20: |
Qualitatives UV/Vis-Absorptionsspektrum der Betainfarbstoffe 13 (oben) und 14 (unten) in Wasser |
|
|
|
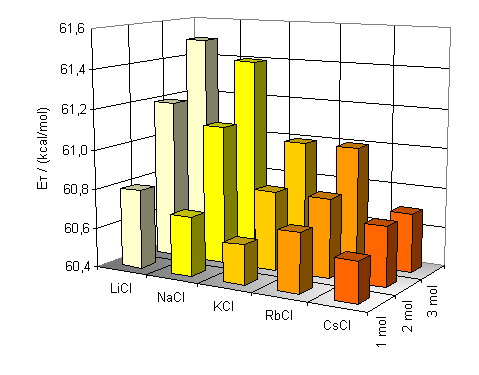
Abb. 21: |
Graphische Darstellung der Abhängigkeit der in Wasser gemessenen ET-Werte der Betaine 13 (oben) und 14 (unten) vom Ionenradius und der Konzentration zugesetzter Alkalichloride |
|
Anhand der ermittelten Werte wird ersichtlich, das die Zugabe von Ionophoren zu Wasser eine hypsochrome Verschiebung der längstwelligen Absorptionsbande bewirkt.
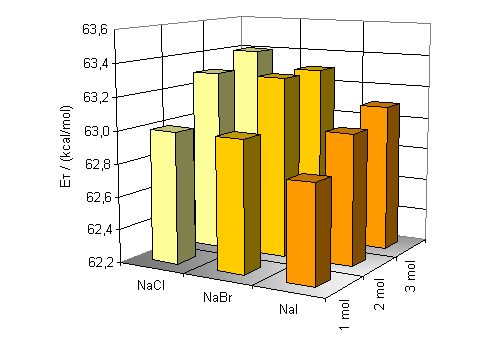
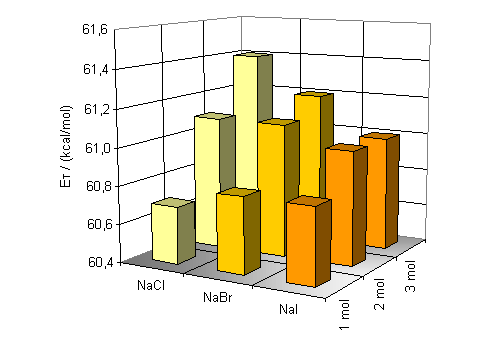
Für kleine Ionenradien, wie beim Lithiumion, ist die Verschiebung am größten. Bei einer Konzentration von 3 mol/l beträgt sie In Abbildung 21 sieht man deutlich die Zunahme der Bandenverschiebung in Abhängigkeit von Konzentration und Ionenradius. Die Grundfläche der Graphen bilden die ET-Werte der Farbstoffe 13 und 14 in reinem Wasser. Die Balken stellen die Anregungsenergie-Änderung zu diesen Werten dar. Konzentrierte Lösungen von Ionen mit kleinem Radius und dementsprechend hoher Ladungsdichte zeigen die größte hypsochrome Bandenverschiebung. Der Einfluß der Anionen auf die Polarität von wäßrigen Salzlösungen wurde ebenfalls untersucht. Dazu wurden ein-, zwei- und dreimolare Lösungen von Natriumchlorid, Natriumbromid und Natriumiodid hergestellt und UV/Vis-spektroskopisch untersucht. Die Aufgrund der geringen Löslichkeit von ca 0.95 mol/l wird Natriumfluorid aus der Diskussion ausgeschlossen. Die erhaltenen Werte der gesättigten Natriumiodidlösung können ebenfalls nicht diskutiert werden. Beim Lösen von Natriumiodid erhält man eine gelbe Lösung. So kann man aufgrund der Eigenabsorption der Lösung trotz verwendeter Gegenküvette keine objektiven Werte erhalten. |
|
|
ET(13)-Werte in kcal/mol |
|||||||
|
1 mol |
2 mol |
3 mol |
gesättigt |
1 mol |
2 mol |
3 mol |
gesättigt |
|
|
NaF |
- |
- |
- |
457 |
- |
- |
- |
62.6 |
|
NaCl |
454 |
452 |
451 |
450 |
63.0 |
63.3 |
63.4 |
63.5 |
|
NaBr |
454 |
452 |
452 |
450 |
63.0 |
63.3 |
63.3 |
63.5 |
|
NaI |
455 |
454 |
453 |
(457) |
62.8 |
63.0 |
63.1 |
(62.6) |
|
Tabelle 19: |
Absorptionsmaxima und ET-Werte des Betains 13, gemessen in wäßrigen Lösungen von Natriumhalogeniden unterschiedlicher Konzentration. |
|
|
ET(14)-Werte in kcal/mol |
|||||||
|
1 mol |
2 mol |
3 mol |
gesättigt |
1 mol |
2 mol |
3 mol |
gesättigt |
|
|
NaF |
- |
- |
- |
472 |
- |
- |
- |
60.6 |
|
NaCl |
471 |
468 |
466 |
463 |
60.7 |
61.1 |
61.4 |
61.8 |
|
NaBr |
470 |
468 |
467 |
n. lösl. |
60.8 |
61.1 |
61.2 |
- |
|
NaI |
470 |
469 |
469 |
n. lösl. |
60.8 |
61.0 |
61.0 |
- |
|
Tabelle 20: |
Absorptionsmaxima und ET-Werte des Betains 14, gemessen in wäßrigen Lösungen von Natriumhalogeniden unterschiedlicher Konzentration. |
|
Auch ein Einfluß der Anionen auf die Lage der Absorptionsmaxima ist deutlich erkennbar. Die hypsochrome Verschiebung der längstwelligen Absorptionsbande ist wie bei den Kationen direkt von der Größe und der Konzentration der Anionen abhängig. Kleine Anionen mit großer Ladungsdichte verursachen die größte hypsochrome Verschiebung. Die Differenzen zwischen den dreimolaren Lösungen von kleinen Anionen (NaCl) und großen Anionen (NaI) beträgt für das Betain 13 In Abbildung 22 erkennt man deutlich die Zunahme der hypsochromen Verschiebung hin zu kleineren Anionen und größeren Konzentrationen. Die Grundfläche der Graphen stellen wieder die ET-Werte der Farbstoffe 13 und 14 in reinem Wasser dar. Die Balken stellen die durch Ionophorzugabe erhaltenen Energiedifferenzen dar. |
|
|
|
Abb. 22: |
Graphische Darstellung der Abhängigkeit der in Wasser gemessenen ET-Werte der Betaine 13 (oben) und 14 (unten) vom Ionenradius und der Konzentration zugesetzter Natriumhalogenide |
|
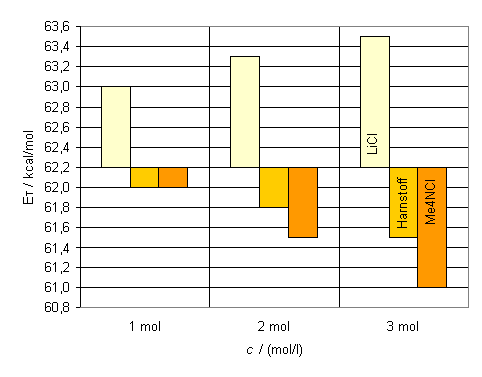
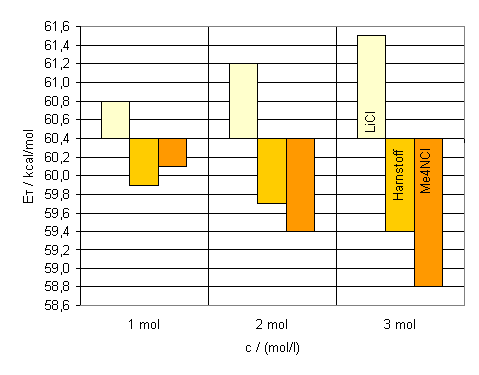
Die hypsochrome Bandenverschiebung, die bei allen Messungen sichtbar wurde, macht deutlich, daß wäßrige Lösungen von Ionophoren polarer sind als reines Wasser. Die Größe der hypsochromen Verschiebung ist dabei direkt von der Ionengröße der Kationen wie auch der Anionen abhängig. Kleine Ionenradien und eine hohe Ladungsdichte führen zu einer stärkeren hypsochromen Verschiebung der längstwelligen Absorptionsbande. In den Abbildungen 21 und 22 fällt auf, daß der Farbstoff 13 schon bei geringen Salzkonzentrationen eine große hypochrome Verschiebung aufweist. Weitere Salzzugaben verursachen jedoch nur noch eine geringe Änderung. Bei höheren Salzkonzentrationen nähern sich die ET-Werte asymptotisch einem Grenzwert. Das entspricht auch den Messergebnissen der bisherigen Versuche[10],[11]. Farbstoff 14 hingegen verhält sich anders. Die Änderung der ET-Werte scheint hierbei linear zu verlaufen. Geringe Salzzugaben führen zu einer geringen hypsochromen Bandenverschiebung. Erst bei höher konzentrierten Salzlösungen erkennt man eine stärkere hypsochrome Verschiebung (s. Abb. 21 und 22). Eine Erklärung für diesen ungewöhnlichen Effekt ist vermutlich, daß hier zwei Effekte gegeneinander wirken. Zum einen führt die erhöhte Polarität zu einer hypsochromen Verschiebung der Absorptionsbande gegenüber reinem Wasser. Zum anderen führt die Wechselwirkung des HBD-Lösungsmittels Wasser mit dem 4-Pyridylstickstoff im Pyridiniumring zu einer bathochomen Verschiebung. Die elektronenziehende Wirkung des 4-Pyridylstickstoffs wird erhöht (s. Kapitel 1.5.1). Fügt man dem Wasser Salz zu, so erhöht sich vermutlich die Wechselwirkung des Lösungsmittels mit dem 4-Pyridylstickstoff nochmals. Das führt dann zu einer weiteren bathochromen Verschiebung, die der hypsochromen Verschiebung, welche man aufgrund der Polaritätssteigerung erhält, entgegenwirkt. Bei höheren Salzkonzentrationen nimmt die bathochrome Verschiebung im Vergleich zur hypsochromen Verschiebung ab. Neben den Salzen sollten auch kovalente organische Verbindungen und großen Kationen mit einer geringen effektiven Ladung untersucht werden. Wäßrige Lösungen der organischen Verbindung Harnstoff wurden bereits mit dem ET(30)-Betain untersucht. Dabei stellte man eine bathochrome Veschiebung fest[42]. Für die Messungen wurden Harnstoff und Tetramethylammonium-chlorid aufgrund ihrer guten Wasserlöslichkeit ausgewählt. Es wurden ein-, zwei- und dreimolare sowie die gesättigten Lösungen hergestellt (gesättigte Lösungen bei 24 °C: c(Harnstoff) ca. 18.15 mol/l; c((CH3)4NH4Cl) ca. 6.00 mo/l). Die |
|
|
ET(13)-Werte in kcal/mol |
|||||||
|
1 mol |
2 mol |
3 mol |
gesättigt |
1 mol |
2 mol |
3 mol |
gesättigt |
|
|
LiCl |
454 |
452 |
450 |
n. meß. |
63.0 |
63.3 |
63.5 |
- |
|
Harnstoff |
461 |
463 |
465 |
473 |
62.0 |
61.8 |
61.5 |
60.4 |
|
(CH3)4NH4Cl |
461 |
465 |
470 |
484 |
62.0 |
61.5 |
60.8 |
59.1 |
|
Tabelle 21: |
Absorptionsmaxima und ET-Werte des Betains 13, gemessen in wäßrigen Lösungen von LiCl, Harnstoff und Tetramethylammonium-chlorid unterschiedlicher Konzentration. |
|
|
ET(14)-Werte in kcal/mol |
|||||||
|
1 mol |
2 mol |
3 mol |
gesättigt |
1 mol |
2 mol |
3 mol |
gesättigt |
|
|
LiCl |
470 |
467 |
465 |
n. lösl. |
60,8 |
61.2 |
61.5 |
- |
|
Harnstoff |
477 |
479 |
481 |
491 |
59.9 |
59.7 |
59.4 |
58.3 |
|
(CH3)4NH4Cl |
476 |
481 |
486 |
505 |
60.1 |
59.4 |
58.8 |
56.6 |
|
Tabelle 22: |
Absorptionsmaxima und ET-Werte des Betains 14, gemessen in wäßrigen Lösungen von LiCl, Harnstoff und Tetramethylammonium-chlorid unterschiedlicher Konzentration. |
|
Die gemessenen Absorptionsmaxima für Harnstoff und Tetramethylammonium-chlorid zeigen eine starke bathochrome Verschiebung. Diese nimmt auch hier bei steigender Salzkonzentration der Lösungen zu. In Abb. 23 kann man deutlich den gegenläufigen Effekt der Lithumchloridlösungen gegenüber den Harnstoff- und Tetramethylammoniumchlorid-lösungen sehen. Lösungen dieser Verbindungen vermindern also offensichlich die Polarität des Wassers. |
|
|
|
Abb. 23: |
Graphische Darstellung der in Wasser gemessenen ET-Werte der Betaine 13 (oben) und 14 (unten) von Harnstoff- und Tetramethylammoniumchloridlösungen in Vergleich zu Lithiumchloridlösungen in unterschiedlichen Konzentrationen. |
|
Zusammenfassend kann man sagen, das wäßrige Ionophorlösungen generell eine hypsochrome Verschiebung der längstwelligen Absorptionsbande bewirken. Salzlösungen in unpolaren Lösungsmitteln wie Acetonitril zeigen eine ähnlichen Effekt[43]. Auch hier beobachtet man eine hypsochrome Verschiebung der längstwelligen Absorptionsbande, die direkt mit dem Ionenradius und der Konzentration zusammenhängt. Da die Ionen in solchen Lösungen ohne abschirmende Solvathülle vorliegen, wird eine spezifische Wechselwirkung zwischen dem Kation und dem negativen Phenolatsauerstoff des Betains 1 ermöglicht. In polaren Lösungsmittel wie Wasser sind die Ionen allerdings von einer Solvathülle umgeben (vgl. Lit.[9], S. 34). Eine spezifische Wechselwirkung zwischen Ion und Farbstoffmolekül ist also nicht möglich. Eine unspezifische Wechselwirkung der Ionen mit dem Farbstoffmolekülen in Wasser läßt sich mit der Theorie der Strukturbildner und der Strukturzerstörer erklären[42], [44], [45]. Die zugegebenen Ionophore wirken als Strukturbildner. Sie erhöhen die Struktur des Wassers und damit die Polarität. Harnstoff und Tetramethylammoniumchlorid hingegen zerstören die Struktur des Wasser und verrringern damit die Polarität. Nach der Theorie der Strukturbildner und Strukturbrecher ergibt sich die Polaritätssteigerung des Wassers bei Zugabe von Ionophorlösungen nicht durch eine direkte Wechselwirkung des Farbstoffmoleküls mit dem Ion, sondern durch die Wechselwirkung des Farbstoffmoleküls mit besonders strukturierten Wassermolekülen. Die Abnahme der Polarität von Strukturbrecher enthaltenden wäßrigen Lösungen beruht demnach auf der Wechselwirkung des Farbstoffmoleküls mit den weniger strukturierten Wassermolekülen. Eine andere Erklärung wäre die, daß man Salze als polare Lösungsmittel betrachtet, die man einem unpolaren Lösungsmittel (in diesem Fall Wasser) hinzufügt. Harnstoff kann man als unpolares Lösungsmittel betrachten, das man einem polaren Lösungsmittel (Wasser) zugibt. Bei der Betrachtung binärer Lösungsmittelgemische beobachtet man nämlich den gleichen Effekt. Gibt man ein unpolares (polares) Lösungsmittel zu einem polaren (unpolaren) Lösungsmittel, so erhält man eine bathochrome (hypsochrome) Verschiebung der Absorptionsbande. Im Kapitel 1.5.3 wird dieser Effekt genauer beschrieben. Die durchgeführten Messungen sind noch nicht ausreichend, um genauere Aussagen zu treffen. Sie zeigen allerdings, daß die Farbstoffe 13 und 14 zur Untersuchung wäßriger Lösungen gut geeignet sind. |
|