|
|
1
|
Allgemeiner und theoretischer Teil |
|
1.1
|
Einleitung und Problemstellung |
|
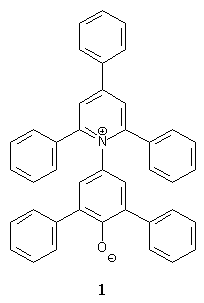
Die ästhetische Wirkung der Farben wird von der Menschheit seit jeher genutzt, um Materialien aller Art optisch ansprechend zu gestalten. Heutzutage werden von der chemischen Industrie verschiedenste Farbstoffe für diesen Zweck angeboten. Sie finden vielfachen Einsatz, so z. B. zum Färben von Textilien. Es gibt aber auch eine Reihe von Farbstoffen, deren Anwendung nicht auf der ästhetischen Wirkung beruht. Die Farbe ist dabei irrelevant, oder sie wird zu anderen Eigenschaften als ihrer Ästhetik genutzt. Solche Farbstoffe, die eine spezielle, wohl definierte Funktion erfüllen, nennt man funktionelle Farbstoffe. Funktionelle Farbstoffe sind weit verbreitet, einer der wichtigsten ist das in der Natur vorkommende Chlorophyll. Aber auch die Industrie bietet eine Reihe funktioneller Farbstoffe an. Sie werden nach lichtabsorbierenden oder lichtemittierenden Eigenschaften, lichtinduzierter Polarisation, sowie photoelektrischer- und photochemischer Aktivität klassifiziert[1]. Einer dieser funktionellen Farbstoffe ist der von Dimroth und Reichardt[2] synthetisierte Betainfarbstoff 2,6-Diphenyl-4-(2,4,6-triphenyl-1-pyridinio)phenolat 1. |
|
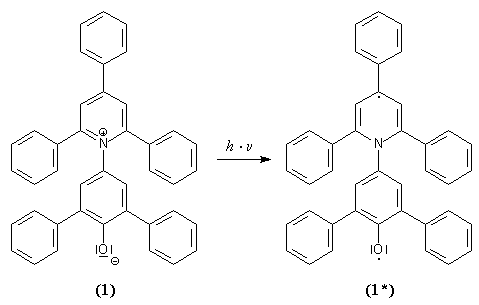
Dieser Pyridinium-N-phenolat-Betainfarbstoff zeichnet sich durch eine lösungsmittel-abhängige Lage seiner längstwelligen intramolekularen Charge-Transfer-Absorptionsbande aus. Dies macht diesen Farbstoff zu einem idealen Indikator zur Messung von Lösungsmittelpolaritäten. In der Chemie spielen Lösungsmittel eine wichtige Rolle. Für viele Reaktionen, vor allem in der organischen Chemie, werden Lösungsmittel eingesetzt. Das Lösungsmittel wirkt sich dabei gravierend auf die Gleichgewichtslage und die Geschwindigkeit der Reaktion aus. Die physikalischen Kennzahlen wie Siedepunkt, Brechungsindex, Dipolmoment etc. sind wichtige, aber oft nicht ausreichende Kriterien zur Wahl des richtigen Lösungsmittels. Ein weiteres, wichtiges Kriterium zur Wahl eines Lösungsmittels ist dessen Polarität, denn dadurch wird das Solvatationsverhalten bestimmt. Die Lösungsmittelpolarität läßt sich aber im Gegensatz zu den physikalischen Eigenschaften nicht einfach direkt messen, da sie von mehreren zwischenmolekularen Kräften zwischen den Molekülen des Gelösten und des Lösungsmittels (Coulomb-, Dispersions-, Induktions-, Richtkräfte etc.) abhängt. Die Polarität verschiedener Lösungsmittel läßt sich nur empirisch bestimmen. Schon früh wurde versucht, anhand von Skalen, genannt seien hier die Z-Werte-Skala von Kosower[3] und die G-Werte-Skala von Allerhand und Schleyer[4], Werte für die Lösungsmittelpolarität anzugeben. Die umfassendste und heute gebräuchlichste Lösungsmittelpolaritätsskala konnte mit dem ET(30)-Betain 1 erstellt werden. Die Bezeichnung ET steht für transition energy und gibt die molare elektronische Anregungsenergie an. Die Zahl 30 ist rein zufällig. Sie stammt daher, daß der Farbstoff 1 in seiner ersten Veröffentlichung[2] die Formelnummer 30 trägt. Zur Erstellung dieser ET(30)-Skala wurden die längstwelligen Absorptionsbanden durch UV/Vis-spektroskopische Messungen von 1 in verschiedenen Lösungsmitteln unterschiedlicher Polarität bestimmt. Bis heute wurden die ET-Werte von über 360 Lösungsmitteln und zahlreichen binären Lösungsmittelgemischen bestimmt[5],[6],[7],[8]. Durch die Absorption von Licht gehen die Elektronen des Farbstoffes 1 vom Elektronengrundzustand in den ersten angeregten Zustand über (Schema 1). Bei polaren Lösungsmitteln wird der Elektronengrundzustand des Betainfarbstoffs 1 durch intermolekulare Wechselwirkungen stärker stabilisiert. Die Energiedifferenz zwischen dem Grundzustand und dem ersten angeregten Zustand ist daher in polaren Lösungsmitteln größer als in unpolaren. Die Energiedifferenz zwischen Grund- und Anregungszustand wächst daher mit zunehmender Lösungmittelpolarität. Das Absorptionsmaximum verlagert sich dabei zu kürzeren Wellenlängen hin. Man bezeichnet ein solches Verhalten einer hypsochromen Bandenverschiebung mit zunehmender Lösungsmittelpolarität als negative Solvatochromie. Farbstoffe mit positiver Solvatochromie zeigen eine analoge Bandenverschiebung zu höheren Wellenlängen (Bathochrome Verschiebung)[9]. |
|
Schema 1: |
Elektronengrundzustand (1) und erster angeregter Zustand (1*) |
|
Aus der Lage der Absorptionsmaxima lassen sich die ET-Werte nach Gleichung (1) berechnen:
|
|
|
|
(cm) |
||
|
|
|
|
(nm) |
(1) |
|
|
mit |
|
= |
Avogadro-Konstante |
|
|
|
|
= |
Planck’ sches Wirkungsquantum |
|
|
|
|
= |
Lichtgeschwindigkeit |
|
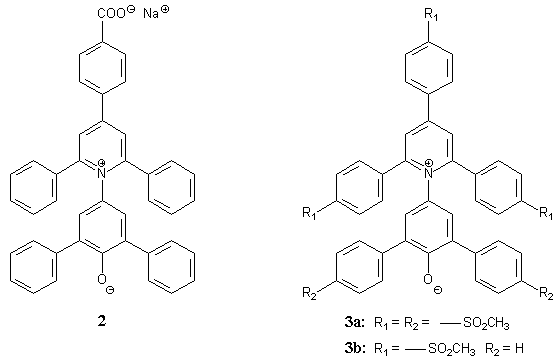
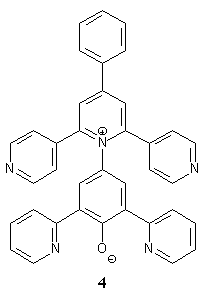
So wurde Farbstoff 2 synthetisiert, der eine Carboxylatgruppe[10] enthält. Damit wurde die Wasserlöslichkeit deutlich erhöht. Allerdings ist dieser Farbstoff aufgrund der Carboxylatfunktion selbst ein Salz. Da aber gerade die Untersuchung der Polarität von wäßrigen Salzlösungen ein interessantes Versuchsfeld ist, wäre dies bei Untersuchungen der Halochromie ein Nachteil. Ein weiterer Versuch, die Wasserlöslichkeit zu erhöhen, ohne dabei ionisierte Substituenten zu verwenden, war die Einführung von hydrophilen Methansulfonyl-gruppen[11]. Damit konnten die Betainfarbstoffe 3a und 3b synthetisiert werden. Allerdings hat die Einfügung dieser hydrophilen Substituenten auch eine Erhöhung der Molmasse zur Folge, so daß diese Farbstoffe nicht mehr wasserlöslich sind. Ziel war es deshalb, einen Farbstoff mit erhöhter Wasserlöslichkeit zu entwickeln, der eine Molmasse ähnlich der des ET(30)-Betains besitzt. Das ist zum Beispiel mit der Substitution einiger oder aller Phenylreste des Betains 1 durch Pyridylreste zu erreichen. Die Überlegung dabei ist die einfache Beobachtung, daß sich Pyridin in Wasser löst, Benzol jedoch nicht. In der Diplomarbeit von Che[12] und in meiner Diplomarbeit[13] sind schon verschiedene Betaine mit Pyridylsubstituenten hergestellt worden. Unter anderem konnte das 4-[4-Phenyl-2,6-bis(4-pyridyl)-1-pyridinio]- 2,6-bis-(2-pyridyl)phenolat 4 hergestellt werden. |
|
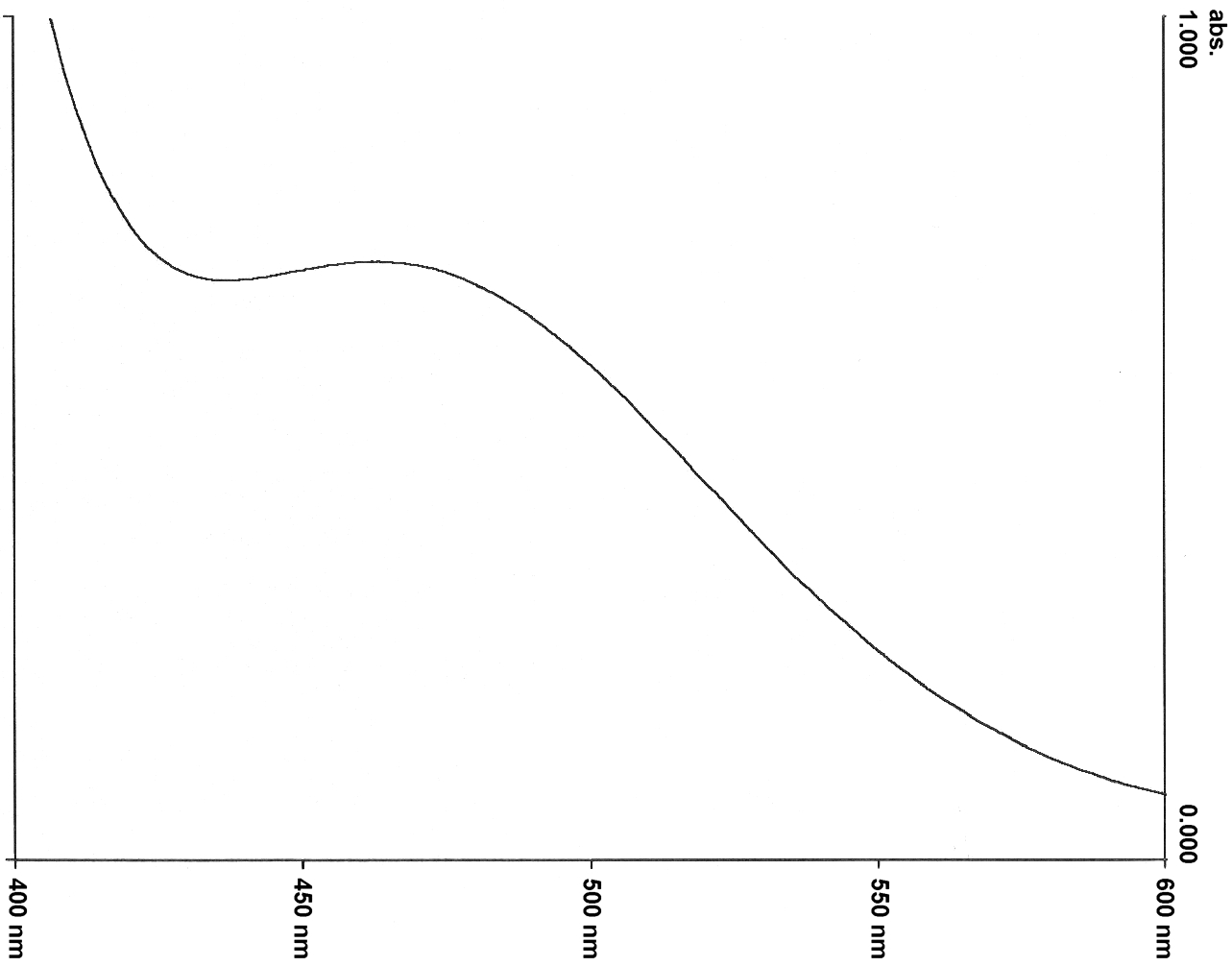
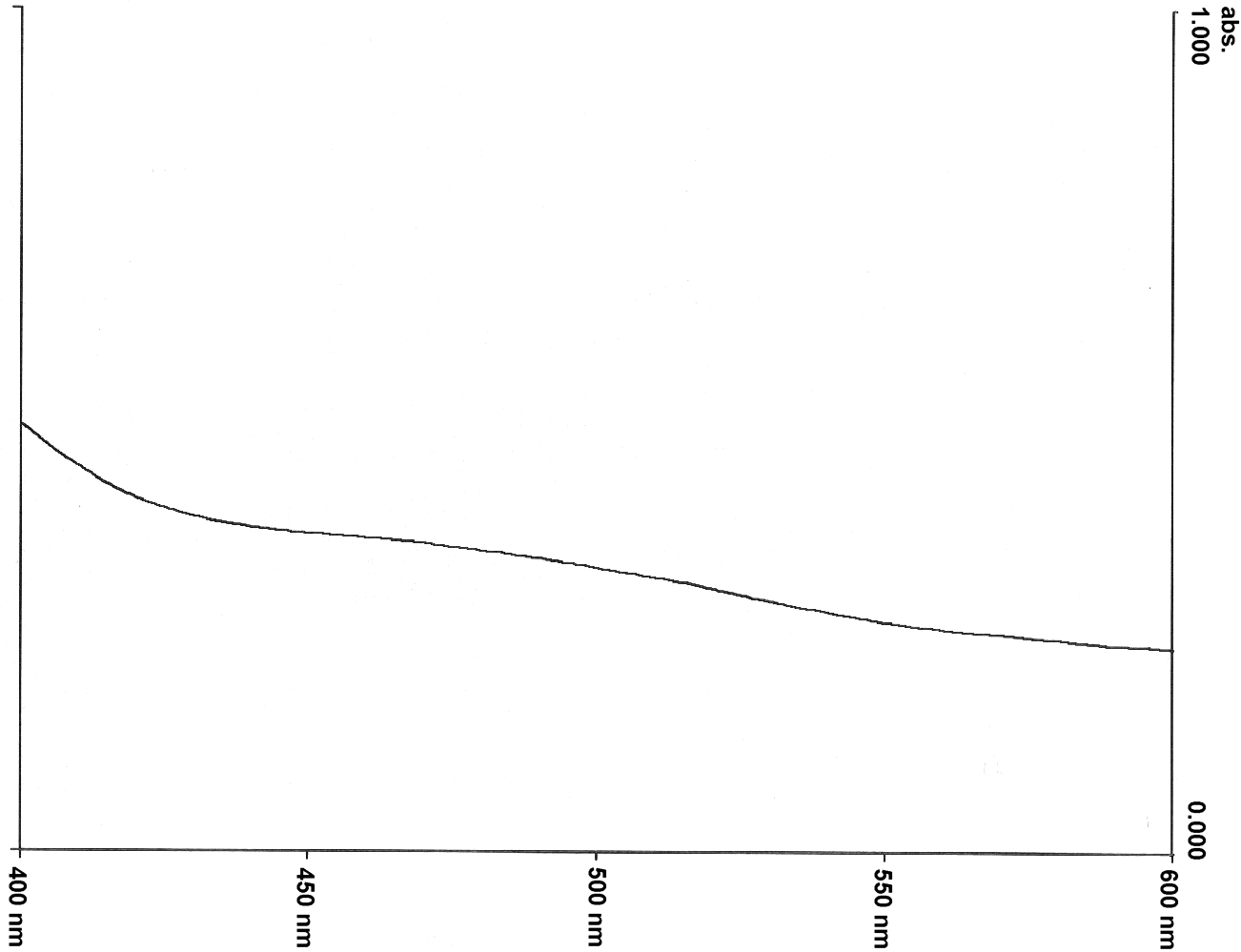
Dieser Farbstoff löst sich sehr gut in Wasser. Er ist auch leicht herzustellen und gut handhabbar. Allerdings hat dieser Betainfarbstoff auch einige Nachteile. Zum einem liegt das längstwellige Absorptionsmaximum sehr nahe an dem ersten kürzerwelligen Absorptionsmaximum (Abb. 1). So kann zwar ein ET-Wert für Wasser bestimmt werden, aber bei Zugabe von Salzen, wie z. B. Natriumchlorid, verschiebt sich das Absorptionsmaximum soweit hypsochrom, daß es nur noch als Schulter in der ersten kürzerwelligen Absorptionsbande vorliegt. In einer einmolaren Lösung von Natriumchlorid in Wasser ist ein Absorptionsmaximum nicht mehr zu erkennen. Zudem ist die Löslichkeit des Farbstoffs schon in einer einmolaren Salzlösung stark herabgesetzt. Die Lösung wird trübe und der Farbstoff salzt aus (Abb. 1). |
|
|
|
Abb. 1: |
Qualitatives UV/Vis-Absorptionsspektrum des Betainfarbstoffs 4 in Wasser (oben) und in 1 molarer wäßriger NaCl-Lösung (unten) |
|
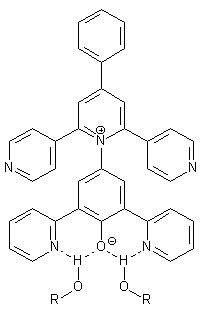
Außerdem tritt bei diesem Farbstoff ein weiterer, unerwünschter Effekt auf. Korreliert man die aus den Absorptionsmaxima des Farbstoffes 4 errechneten ET-Werte mit den ET(30)-Werten von Betain 1, so erkennt man, daß die Ausgleichsgerade durch die ET-Werte der HBD-Lösungmittel (HBD = Wasserstoffbrückendonator) eine geringere Steigung hat als die der Nicht-HBD-Lösungsmittel. Dies ist ein Effekt, der schon in der Dissertation von Niem[14] beschrieben und in der Diplomarbeit von Libor[15] genauer untersucht wurde. Durch die Einführung der 2-Pyridylsubstituenten in den Phenolatteil von Betain 4 wird es den HBD-Lösungmitteln ermöglicht, nicht nur mit dem basischen Phenolat-Sauerstoffatom, sondern auch mit dem freien Elekronenpaar des Stickstoffatoms der Pyridylreste in Wechselwirkung zu treten (Schema 2). |
|
Schema 2: |
Wechselwirkung des Betainfarbstoffs 4 mit HBD-Lösungsmitteln. |
|
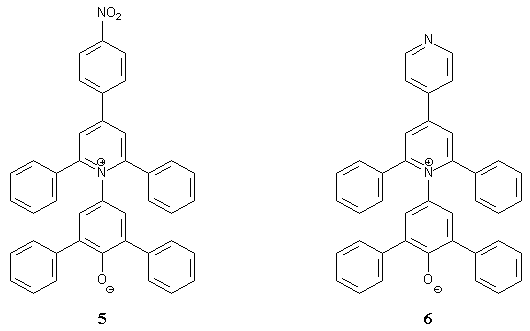
Das führt zu einer stärkeren Annäherung der HBD-Lösungsmittelmoleküle an das Phenolatsauerstoffatom des Betainfarbstoffs 4 im Vergleich zu dem des Standardbetains 1 und damit zu einer größeren Stabilisierung des Elektronengrundzustandes. Die ET-Werte der HBD-Lösungsmittel weichen deshalb von denen der Nicht-HBD-Lösungsmittel ab. Für die HBD-Lösungsmittel zeigt sich eine verminderte Solvatochromie. Da alle bisher hergestellten Betaine, die zwei oder mehr Pyridylsubstituenten enthalten, sich in Wasser lösen, sollten in der vorliegenden Dissertation weitere pyridylsubstituierte Betainfarbstoffe synthetisiert werden. Zur besseren Untersuchung der Interaktion der HBD-Lösungsmittel mit den Farbstoffen sollten jetzt Betainfarbstoffe synthetisiert werden, die nur noch gleiche Pyridylreste enthalten. Ein Farbstoff soll also nur noch 2- oder 4-Pyridylsubstituenten enthalten. Zudem sollten auch 3-pyridylsubstituierte Farbstoffe synthetisiert werden. Damit soll geklärt werden, welche Pyridylsubstituenten den größten Einfluß auf die Wasserlöslichkeit haben. Die Synthese von 1,3-Bis-(4-pyridyl)propan-2-on, einer wichtigen Vorstufe zur Synthese 4-pyridylsubstituierter Betainfarbstoffe, gelang trotz intensiver Versuche in meiner Diplomarbeit[13] bisher nicht. Deshalb sollten in dieser Dissertation weitere Synthesemöglichkeiten ausprobiert werden. Des weiteren soll untersucht werden, wie sich die Lage des Stickstoffatoms im Phenolatteil des Betainfarbstoffs auf die Wechselwirkung des Betainfarbstoffs mit dem HBD-Lösungsmittel auswirkt. Durch die größere Entfernung des 4-Pyridylsubstituenten am Phenolatteil des Farbstoffs vom Phenolatsauerstoffatom sollte der oben beschriebene Effekt verschwinden oder zumindest kleiner sein als bei den Farbstoffen mit 2-Pyridylsubstituenten. Es ist auch interessant zu erfahren, ob und wie dieser Effekt bei den 3-pyridylsubstituierten Betainfarbstoffen auftritt. Zudem muß das längstwellige Absorptionsmaximum bathochrom verschoben werden, damit dieses bei der Messung von wäßrigen Salzlösungen nicht durch die dabei auftretende hypsochrome Verschiebung als Schulter in der ersten kürzerwelligen Absorptionsbande verschwindet und so nicht mehr bestimmbar ist. Dazu gibt es verschiedene Möglichkeiten. In der Dissertation von Müller[16] wurde unter anderem bei der UV/Vis-spektroskopischen Untersuchung des Betainfarbstoffs 5 festgestellt, daß durch Substitution eines H-Atoms in einem der Phenylreste durch eine Nitrogruppe die molare Anregungsenergie gegenüber der des Standardbetains gesenkt werden kann. Das zeigt sich in einer bathochromen Veschiebung der längstwelligen Absorptionsbande von 5 gegenüber der des Farbstoffs 1. Der Effekt ist bei der Substitution durch eine Nitrogruppe in der Paraposition von allen in der Dissertation von Müller[16] untersuchten Resten am größten. |
|
Die Substitution eines H-Atoms durch eine Nitrogruppe hat allerdings den Nachteil, daß dadurch die Wasserlöslichkeit wieder herabgesetzt wird. Es gibt jedoch noch weitere Substituenten, die eine ähnliche bathochrome Verschiebung zu Farb- stoff 1 zeigen. So zeigt auch der methansulfonylsubstituierte Farbstoff 3b einen ähnlichen Effekt, aber auch der von Che [12] hergestellte Farbstoff 6, bei dem ein Phenylrest durch einen 4-Pyridylrest ersetzt wurde. Die Auswirkungen dieser Substituenten auf die längstwellige UV/Vis- Absorptionsbande ist am Beispiel des Lösungsmittels Acetonitril in Tabelle 1 zusammengefasst. |
|
Betain |
|
ET-Werte in kcal/mol |
|
|
1 |
627 |
45.6 |
- |
|
3b |
706 |
40.5 |
5.1 |
|
5 |
682 |
41.9 |
3.7 |
|
6 |
670 |
42.7 |
2.9 |
|
Tabelle 1: |
Absorptionsmaxima und ET-Werte der Betaine 1, 3b, 5 und 6, gemessen in Acetonitril |
|
Zur Untersuchung der Einflüsse auf die Wasserlöslichkeit sollten diese drei Substituenten bei der Synthese neuartiger pyridylsubstituierter Betainfarbstoffe eingesetzt werden. Entsprechend den vorangegangenen Überlegungen sollten die folgenden 15 Betainfarbstoffe synthetisiert werden. Die Farbstoffe 7 und 9 wurden bereits in meiner Diplomarbeit[13] beschrieben. Damit sollen 13 neue Betainfarbstoffe synthetisiert werden. Für die Gruppe der |
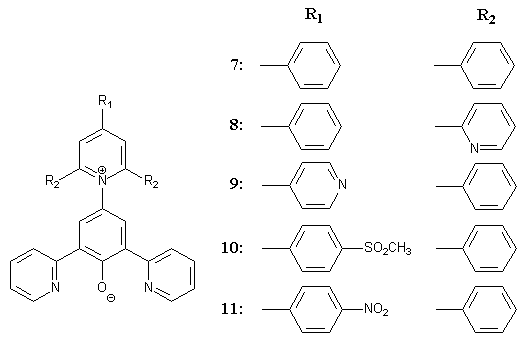
|
Für die Gruppe der 3-pyridylsubstituierten Betaine sollten die Farbstoffe 12, 13, 14, 15, und 16 hergestellt werden: |
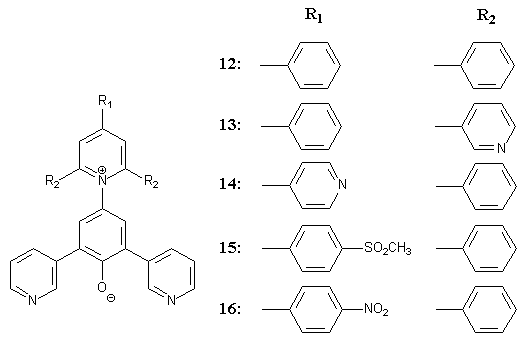
|
Für die Gruppe der 4-pyridylsubstituierten Betaine sollten die Farbstoffe 17, 18, 19, 20, und 21 hergestellt werden: |
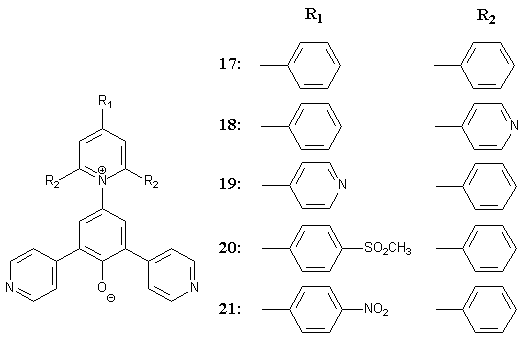
|
Dazu muß versucht werden, 1,3-Bis(4-pyridyl)propan-2-on zu synthetisieren, das trotz intensiver Bemühungen bisher nicht zugänglich war[13]. Aus dieser Reihe von Farbstoffen sollen dann der oder die geeignetsten für die UV/Vis-spektroskopische Messungen wäßriger Ionophorlösungen ausgesucht und verwendet werden. |
|