Aus dem Institut für Normale und Pathologische Physiologie
der Philipps-Universität Marburg
Arbeitsgruppe Neuroendokrinologie
Geschäftsführender Direktor: Prof. Dr. Dr. J. Daut
![]()
Multimediale Simulationen
physiologischer Grundprozesse
und ihre Einbettung in
interaktive Lernsysteme
Inaugural-Dissertation
zur Erlangung des Doktorgrades der Humanbiologie
dem Fachbereich Humanmedizin der
Philipps-Universität Marburg
vorgelegt
von
Dipl. Physiker Carsten Eichmann
aus Wilnsdorf
Marburg 1998
![]()
Angenommen vom FachbereichHumanmedizin
der Phillips-Universität Marburg am: 10. Dezember 1998
Gedruckt mit Genehmigung des Fachbereichs.
Dekan: Prof. Dr. H. Schäfer
Referent: Prof. Dr. K. Voigt
Korreferent: Prof. Dr. K. Kuhn
![]()
3.4 Aufbau eines Skelettmuskelversuches
5.3 Automatische Protokollführung
5.5 Die Muskelanimation in SimMuscle
5.7 Der Algorithmus von SimMuscle
9.1 Indizierte Farben der Systempalette
9.2 Muskelbilder der isometrischen Kontraktion
9.3 Bewegliche Objekte mit beweglichen Endpunkten
9.4 Hintergrundbilder der beweglichen Objekte
Abkürzungsverzeichnis
ACh = Acetylcholin
Adr = Adrenalin
At = Atropin
DAG = Diacylglycerol
div = division (dimensionslose Skaleneinheit)
ED
x = x% des Maximalausschlageset al. = und andere
gSt = Gamma-Strophantin
Hz = Hertz
ID = Indentifikations-Nummer
IP3 = Inositoltrisphosphat
NA = Noradrenalin
Phe = Phentolamin
Pro = Propranolol
Ver = Verapamil
1 Einleitung
1.1 Ausgangspunkte
Das Ziel einer wissenschaftlichen Ausbildung ist, den Studenten dazu zu bringen, selbstständig wissenschaftlich zu arbeiten. Neben der Vermittlung von theoretischem Wissen, sind praktische Übungen ein wichtiger Bestandteil des Studiums.
Im Rahmen biologischer, pharmakologischer, pharmazeutischer und medizinischer Ausbildungen kommen dabei recht häufig Tierversuche zum Einsatz, wobei Frösche, Ratten, Mäuse und Kaninchen die häufigsten Versuchstiere abgeben.
In der Mehrzahl der Fälle handelt es sich dabei nicht um Tierversuche im engeren Sinne, bei denen Versuche am narkotisierten Tier vorgenommen werden. Stattdessen handelt es sich in der Mehrzahl der Fälle um sogenannte Organentnahmen. Dabei werden dem Tier die für das Experiment benötigten Organe entnommen und mit diesen wird dann experimentiert. Es sollen diese Versuche im Folgenden als Organversuche bezeichnet werden, um sie eindeutig von den eigentlichen Tierversuchen abzugrenzen.
Tier- und Organversuche bergen verschiedene Problematiken:
Ethische Bedenken und Verweigerungshaltungen der Studenten führen häufig zu einer Lehr- und Lernathmosphäre, die konstruktive Diskussionen und intensive Auseinandersetzung mit den Inhalten nicht zulassen.
Aufgrund von Tierschutzbemühungen wird die Anzahl von Studenten pro Präparat immer höher, so daß der Lernerfolg für den Einzelnen immer fraglicher wird.
Der apparative Aufwand ist recht hoch und sehr speziell.
In Vorlesungen und Seminaren sind derartige Versuche kaum sinnvoll durchführbar.
Operative Unzulänglichkeiten der Studenten führen allzuhäufig zum Ausfall des Präparates.
Die wachsenden Studentenzahlen machen intensive Versuche und gemeinsame Diskussionen immer schwieriger.
Um diese Problematiken zu umgehen, gleichzeitig aber die didaktischen und inhaltlichen Vorteile von Tier- und Organversuchen der Lehre zu erhalten, sollten im Rahmen dieser Arbeit mit Hilfe modernster Technologien praxisnahe multimediale Simulationen der klassischen Tierversuche entwickelt werden.
Es war das Ziel der vorliegenden Arbeit, modernste Computertechnologien, wissenschaftliche Modelle und Simulationsalgorithem zu kombinieren, um dem Dozenten ein leistungsfähiges Werkzeug zur Ausbildung der Studenten an die Hand zu geben.
Darüberhinaus sollte es dem Dozenten möglich gemacht werden, die Experimente nicht nur in aufwendig ausgestatteten Praktikumsräumen sondern im Hörsaal und Seminarraum mittels Projektion an der Wand durchführen zu können.
Der Dozent sollte ein Lehrmittel an die Hand bekommen, mit dem er in die Grundlagen wissenschaftlichen Arbeitens einführen kann. Was bisher mit abstrakten Diagrammen, Overheadfolien und Tafelbildern gezeigt wurde, soll nun sukzessive an der Hörsaalwand experimentell erarbeitet werden. Dadurch wird Wissen lebendig, spannend und wissenschaftlich, denn das Experiment ist Grundlage des naturwissenschaftlichen Denkens und Handelns.
Deshalb sollte ein Programm entstehen, das für den Einsatz in Vorlesungen, Seminaren und Praktika geeignet ist und das dem Dozenten alle Freiheiten läßt, die er von realen Versuchen her gewohnt ist.
Das Programm sollte den Dozenten weder in der Reihenfolge der Experimente, noch in der Wahl der Parameter irgendwelche, auf didaktischen Überlegungen basierenden Vorgaben aufzwingen. Im Gegenteil: Ziel war es, die Programme so universell und flexibel zu halten, daß der Dozent seine über Jahre entwickelte und bewährte Praktikumsanleitung unverändert oder nur leicht überarbeitet weiter verwenden sollte.
Den experimentellen Grundansatz der Biowissenschaften wieder stärker in die Lehre zu integrieren - das war das primäre Ziel bei der Entwicklung von SimMuscle, SimVessel und SimHeart.
Es ging also nicht darum, eine Alternative zu Tierversuchen in der Ausbildung zu entwickeln, sondern neue Formen der Ausbildung durch Entwicklung neuer, computerbasierter Lehrmittel zu finden.
1.2 Welche Programme dieser Art existieren schon ?
Es gibt eine Reihe von kommerziellen Softwareprodukten und wissenschaftlichen Ansätzen, die ähnliche Ziele verfolgen.
STOL ist ein an der Universität Heidelberg entwickeltes Programm, das Experimente an der Nervenzellmembran erlaubt. Messungen von Diffusions-, Ruhe- und Aktionspotentialen in Abhängigkeit bestimmter Parameter sowie einfache Voltage-Clamp-Simulationen sind möglich. Auch lassen sich Ionengradienten verändern und Kanäle reversibel blockieren.
Die Bedienung ist einfach, die Anmutung aber sehr karg und wissenschaftlich. Der Anwender erhält keinen Eindruck des realen experimentellen Setups. Insgesamt ähnelt das Programm eher einem interaktiven Diagramm als der Simulation eines Experimentes.
Die an die Universität Sheffield assoziierte Firma BioScience vertreibt eine Reihe von Programmen, die eine Kombination von Selbstlernprogrammen und Simulationen darstellen.
So entspricht das Programm MusclePhysiology inhaltlich in etwa dem im Rahmen dieser Promotion durchgeführten SimMuscle, jedoch ist der Grundansatz ein komplett anderer. BioScience verwendet nämlich eingescannte Versuchsergebnisse. Das Programm ist also eine Art Datenbank, die in Abhängigkeit einer (sehr weniger) Parameterkonstellationen das zugehörige Bild aus der Datenbank heraussucht und präsentiert. Physiologische Variabilitäten bleiben dabei ebenso unberücksichtigt wie die freie Wahl der Parameter und die Präparation des Muskels. Auch das Interface des Programms ist nicht mehr zeitgemäß und vermittelt in keinster Weise die reale Laborathmosphäre.
Ähnliches gilt für das Programm Langendorff Heart, das in seinem Anspruch mit SimHeart gleichgesetzt werden kann. Auch hier kommen eingescannte Originalversuche zum Einsatz, wird die Apparatur nur sehr schematisch dargestellt und die Präparation wird gar nicht gezeigt.
Das Programm Guinea Pig Ileum ist hier deutlich variabler. Das Verhalten des Muskels wird zur Laufzeit berechnet, eine ganze Reihe von physikalischen und biochemischen Parametern sind veränder- und kombinierbar. Leider wird der funktionelle Antagonismus zwischen der glatten Muskulatur des Verdauungstraktes und z.B. der Gefäße nicht berücksichtigt und auch die Präparation des Ileums wird nicht gezeigt. Ebenfalls ist zu bemängeln, daß das Interface keine Laborathmosphäre verbreitet sondern eher dem Schema der Versuchsanordnung entspricht. So angemessen auf den ersten Blick eine Echtzeitprogrammierung ist, so unerfreulich ist sie dann in der Realität. Versuche am glatten Muskel sind sehr langwierig - und das sind sie in der Simulation von BioScience auch. Gerade dieser Faktor ist es aber, der im realen Praktikum immer wieder verhindert, daß diese Versuche durchgeführt werden.
Für alle Programme von BioScience gilt, daß es erläuternde Texte und Abbildungen, Diagramme und Vorgaben gibt, die den Einsatz des Programms in Vorlesungen ebenso einengen wie die sehr sterile, computergewohnte Bildschirmgestaltung und die abstrakte Benutzerführung. Dadurch fordert die Bedienung der Programme fast ebensoviel Aufmerksamkeit wie die physiologischen Inhalte, was weder dem Dozenten noch dem Studenten zumutbar ist.
An der Universität Groningen wird ein Lehrkonzept entwickelt, das sowohl die Präparation, wie auch Versuchsanordnung und Versuche zum Gegenstand hat. Obwohl das Programm als
"Simulation" bezeichnet wird, hat es damit eigentlich nichts zu tun, denn es basiert rein auf Videosequenzen, die aufwendig von Bildplatte zu laden sind. Das Programm ist interaktiv, indem es immer wieder anhält und Fragen stellt, von realen Simulationen ist es allerdings weit entfernt.Ähnliches gilt für FARID, das eine videodisc-basierte Darstellung einer Rattenpräparation darstellt.
Die Firma BioSoft aus England hat die Programme Neurosim und CardioLab im Programm. Beide Programme sind inzwischen in die Jahre gekommen und bieten eine nicht mehr zeitgemäße Funktionalität. Die Bildschirmgestaltung läßt intuitives arbeiten in keinster Weise zu. Auch sind lediglich (eingescannte) Kurven zu sehen, so daß der experimentelle Ansatz und die Gewinnung des Präparates in keiner Weise Berücksichtigung findet.
BIO-LOGIC PHYSIOLOGY SOFTWARE bietet ebenfalls eine ganze Palette von Simulationen an. Die Programme Bio-Patch, Heart, Mempot, Artmen, Memcable und Jpcalc haben die Biomembran, ihre Potentiale sowie die zugehörigen Experimente zum Thema. So gut die mathematischen Modelle hinter diesen Programmpaketen zum Teil auch seien mögen - Benutzerführung und Bildschirmgestaltung lassen einfach nicht annähernd eine experimentelle Atmosphäre entstehen. Die Darstellungen der Kurven und des experimentellen Setups in schlichtem schwarz-weiß Outfit wirken wie animierte und interaktive Diagramme - aber nicht wie ein Labor. Die Schritte, die der Anwender zur Gewinnung von Ergebnissen gehen muß, haben mit den Schritten im realen Labor zu wenig zu tun, als das ein Transfer von der Computersimulation zum realen Labor möglich wäre.
Dasselbe ist zu den sieben Programmen aus der Reihe COMPUTER-BASED EXERCISES FOR PHYSIOLOGY zu sagen. Die Programme Cardiovascular Physiology I und II, Problems in Fluid Comparment Re-Distribution, Muscle Mechanics, CIRCSIM, GASP und ABASE vom Physiologischen Institut am Rush Medical College in Chicago sind in ihrer Visualität abstrakt und technisch und haben den Realitätsgrad einer Strichzeichnung. Die vielen Zahlenkolonnen schrecken ebenso ab wie die vielen Formeln, die schwarz-weiß Optik und die statischen Diagramme.
Ins genaue Gegenteil schlägt das Programm THE GRAPHIC BRAIN SOFTWARE der Firma F.A. Davis. In den 16 Programmmodulen zu allen wesentlichen Bereichen der Neurophysiologie steht die visuelle Umsetzung eindeutig im Vordergrund. Bunte, auf den ersten Blick attraktive Bilder laden zum Studium ein. Das Studium aber ähnelt zu sehr einer Mischung aus Buch und Fernsehen. Animationen veranschaulichen Sachverhalte - aber der Anwender kann nicht eingreifen. Der Anwender bleibt inhaltlich passiv, das heißt er setzt sich zu keinem Zeitpunkt aktiv mit den Inhalten sondern immer nur mit der Benutzerführung auseinander. Da die 16 Programme alle mit Lesetext und didaktischem Konzept versehen sind, sind sie für den Einsatz in Vorlesungen weitgehend unbrauchbar. Allenfalls zum Heimstudium könnte man sie empfehlen. Hier aber schreckt der hohe Preis von 400US$.
Das Programm Pharmatutor aus der Schweiz besitzt dasselbe Handicap. Zwar werden die Reaktionen des Präparates zur Laufzeit berechnet, dafür sind Bildschirmaufbau und Benutzerführung fade und wenig intuitiv. Weder Präparation noch Versuchsaufbau werden gezeigt, so daß das Programm nicht dazu geeignet scheint, in die realen Experimente einzuführen oder diese auch nur annähernd zu ersetzen. Das Programm eignet sich eher dazu auf abstrakte Weise in die Pharmakokinetik einzuführen.
Es gibt am Markt noch eine ganze Reihe weiterer Ansätze. Berücksichtigung fanden hier allerdings nur jene Programme, die den Anspruch einer "Simulation
" für sich erheben und mit Programmen wie SimHeart, SimMuscle und SimVessel in Konkurrenz treten könnten.
2 Problematik- Fragestellung
Das Ziel der Arbeit ist es, drei interaktive Lernprogramme zu entwickeln, mit denen es möglich ist, klassische physiologische Versuche in der Lehre mit hohem Realitätsgrad zu simulieren. Alle physiologischen Lerninhalte der realen Versuche sollten mit diesen multimedialen Simulationen vermittelt werden können. Um dieses zu erreichen ist es wichtig Realitätsnähe und Anwenderfreundlichkeit miteinander zu verbinden.
Zur Vertiefung theoretisch gelernter Inhalte sind praktische Übungen in Form von Versuchen sehr wichtig. Damit die Lernprogramme das Gefühl eines realen Experimentes vermitteln, müssen bei ihrer Realisierung folgende Kriterien beachtet werden:
Die Algorithmen, die die Messkurven generieren, sollten die Realität hinreichend genau simulieren (z.B. Schwankungen der physiologischen Parameter berücksichtigen) und Echtzeitverhalten besitzen.
Der Anwender muß die Möglichkeit haben Fehler zu machen und aus diesen zu lernen.
Der optische Eindruck des Labors und die Funktionsweise der Geräte sollte möglichst realistisch sein.
Die Reihenfolge der Versuche und der Einstellung der Versuchsparameter sollte frei von dem Anwender bestimmt werden können (kein didaktisches Schema).
Außerdem sollte gewährleistet sein, daß die Dozenten ihre im realen Praktikum erprobten Praktikumsanleitungen im großen und ganzen weiterverwenden können.
Um dem Benutzer die Arbeit mit den Programmen zu erleichtern, sollten bei der Realisierung der Programme neben den Human Interface Guidelines der medizinischen Fachverlage [4] folgende Kriterien berücksichtigt werden:
Der Aufbau der Programme sollte klar strukturiert sein, um die Handhabung zu erleichtern und wichtige Lerninhalte herauszustellen.
Die Programme sollten selbsterklärend sein, damit der Student, der sich nur einen Nachmittag mit dem Programm beschäftigt, nicht unnötig mit Anwenderproblemen konfrontiert wird.
Die Bedienung der Programme sollte so unauffällig wie möglich sein, um der inhaltlichen Auseinandersetzung nicht im Wege zu stehen.
3 Physiologischer Hintergrund
Für die Simulationen wurden drei Muskelversuche ausgewählt, um das gesamte Spektrum der Muskelpraktika abzudecken: 1.) der Skelettmuskelversuch, 2.) der Versuch zur glatten Muskulatur und 3.) der Herzmuskelversuch nach Langendorff.
3.1 Skelettmuskulatur
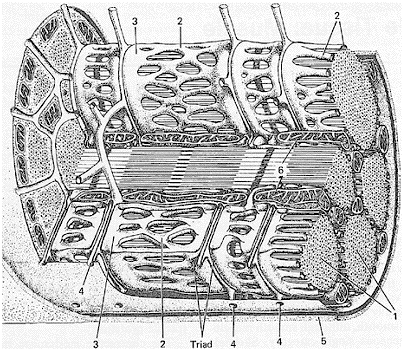
Abb. 3.1.1: Aufbau einer Skelett-Muskelfaser. Im Querschnitt des Muskels sind die Aktin- und Myosinfilamente zu sehen (1). Das Sarkoplasmatische Retikulum (2) mit seinen terminalen Zisternen (3) umschließt jede Myofibrille. Die transversalen Tubuli (4) sind Einstülpungen des Sarkolemms (5) und bilden zusammen mit dem Sarkoplasmatischen Retikulum die Triad. Skelettmuskelfasern enthalten viele Mitochondrien (6). Entnommen aus [2].
Die Skelettmuskulatur des Bewegungsapparates ist der am höchsten organisierte Muskeltyp. Histologisch spiegelt sich diese Tatsache in der Querstreifung des Muskels wider; aus diesem Grunde wird die Skelettmuskulatur (und die Herzmuskulatur) auch quergestreifte Muskulatur genant.
Im Unterschied zur Herzmuskulatur und glatter Muskulatur wird der Selettmuskel willkürlich angespannt und rein nerval erregt.
Die Kontraktion des Skelettmuskels hängt von den Proteinen Myosin, Aktin, Tropomyosin und Troponin ab. Sie sind die Grundlage der kleinsten kontraktilen Einheit - dem Sarkomer:

Abb. 3.1.2: Aufbau eines Sarkomers der quergestreiften Muskulatur. Entnommen aus [5].
Ein Sarkomer besteht aus etwa 2000 dünnen Aktinfilamenten und an die tausend dicken, bipolar angeordneten Myosinfilamenten [23]. Um die Aktinfilamente ist das faserförmige Tropomyosin gewickelt. An diesem ist alle 40 nm ein Troponin-Molekül angehaftet [5]. In Längsrichtung des Muskels sind die Sarkomere durch plattenförmige Strukturen, die Z-Scheiben, miteinander verbunden. Jedes Aktinfilament ist in der Mitte an einer Z-Scheibe fixiert. Zwischen den Aktinfilamenten befinden sich die Myosinfilamente, die über Myosinköpfchen temporär gelenkartig mit den Aktinfilamenten verbunden sind.
Durch die Hintereinanderreihung von Sarkomeren zu Myofibrillen addieren sich die Einzelkontraktionen der Sarkomere. Die Myofibrillen durchziehen den Muskel auf seiner gesamten Länge und können bis zu 20 cm lang sein. Umgeben sind sie von geschlossenen Kammern - dem sarkoplasmatischen Retikulum. Es dient zur Speicherung von Kalzium-Ionen. Da die Kammern des sarkoplasmatischen Retikulums vor allem längs der Myofibrillen verlaufen, spricht man auch von longitudinalen Tubuli.
Eine Muskelfaser(-zelle) enthält einige Hundert Myofibrillen. Die Zellmembran der Muskelzelle, das Sarkolemm, umschließt außer den Myofibrillen Zytoplasma, mehrere Zellkerne, viele Mitochondrien, Lysosomen, Fetttröpfchen, Glykogen- und andere Einschlüsse [5]. Sie ist an vielen Stellen senkrecht zu den Muskelfibrillen schlauchartig eingestülpt: die transversalen Tubuli. Sie gehören noch zum Extrazellulärraum der Zelle.
Eine motorische Einheit wird gebildet aus einem Motoneuron und dem von ihm innervierten Kollektiv von Muskelfasern. Die Anzahl der von einem Neuron versorgten Muskelfasern und die Anzahl der motorischen Einheiten eines Muskels variieren sehr stark:
Tab 3.1: Große und kleine motorische Einheiten von Skelettmuskeln (entnommen aus [23]).
|
Muskel |
Rectus oc. lat. |
Biceps brachii |
|
Motorische Einheiten des Muskels |
1740 |
774 |
|
Muskelfasern pro Einheit |
13 |
750 |
Die Anzahl der motorischen Einheiten eines Muskels ist ein Maß für die Feinregulation der Bewegung.
Die Muskelfasern sind in (sichtbaren) Muskelfaserbündeln angeordnet, welche jeweils vom Perimysium umgeben sind:

Abb. 3.1.3: Feinbau der Skelettmuskulatur. Entnommen aus [5].
Die Aufgabe eines Muskels ist es, chemische Energie, die in Form von ATP gespeichert ist, in mechanische Energie umzuwandeln. Ein Prozeß, den man als als elektromechanische Kopplung bezeichnet.
Im Gegensatz zur Herzmuskulatur und zur glatten Muskulatur wird die Skelettmuskulatur willkürlich angespannt. Die Muskelfasern werden dabei durch die jeweiligen Motoneurone aktiviert. Die Aktionspotentiale der Motoneurone setzen an den Endplatten der jeweiligen Muskelfasern Acetylcholin frei und generieren dadurch einen Endplattenstrom. Bei einem überschwelligen Reiz wird in der Muskelfaser ein Aktionspotential erzeugt, welches sich entlang des Sarkolemms über die gesamte Faser ausbreitet. Das Aktionspotential nimmt dabei nicht an Stärke ab, da Muskeln ebenso wie Nerven die Fähigkeit haben elektronische Impulse verlustfrei weiterzuleiten. Durch die Einstülpungen in der Membranwand, den transversalen Tubuli, wird der Reiz ins Innere der Muskelfaser geleitet. Dadurch werden aus den angrenzenden longitudinalen Tubuli innerhalb von 1-2 ms über 250 nmol Kalzium pro Gramm Muskel im Inneren der Myofibrillen freigesetzt [16].
Die Erhöhung der intrazellulären Kalziumkonzentration löst nach der Gleitfilamenttheorie eine Reihe von Reaktionen aus, die schließlich zur Muskelkontraktion führen [5]:
In Ruhe sind die Myosinköpfe nicht mit den Aktinfilamenten verbunden - der Muskel ist leicht dehnbar. An jedem Myosinkopf wird ein ATP-Molekül gebunden. Der dadurch entstehende Winkel zwischen dem Myosinkopf und dem restlichen Myosinmolekül beträgt 90° [19].
Das im Skelettmuskel vorhandene Troponin besteht aus drei Untereinheiten: TN-C, TN-T und TN-I. Das erstere geht die Kalzium-Bindung ein, das zweite bindet an Tropomyosin und das letztere verhindert die Brückenbindung zwischen Aktin und Myosin. Durch Kalziumsättigung von TN-C wird der hemmende Effekt von TN-I aufgehoben [16, 17]. Dadurch legt sich der Tropomyosinfaden in die Rinne zwischen den beiden miteinander verdrillten Aktin-F-Ketten und gibt so die Bindungsstelle für den Myosinköpfe an das Aktinfilament frei. Es bildet sich eine stark bindende Querbrücke zwischen den Köpfen und dem Aktinfilament [13, 14, 15].
Aktin aktiviert dadurch die ATPase des Myosinkopfes, welche unter Beteiligung von Magnesiumionen, das ATP in ADP und Phosphat spalten [12].
Die darauf folgende Ablösung des ADP und des Phosphates führt zu einer Verringerung des Winkels der Myosinköpfe auf etwa 45°. Da die Aktinfilamente fest mit den Myosinköpfen verbunden sind, werden die Aktinfilamente in Richtung der gegenüberliegenden Z-Scheibe geschoben (um ca. 10 nm) [23].
Durch erneute Bindung von ATP-Molekülen an die Myosinköpfe lösen sich diese wieder von den Aktinfilamenten. Der Winkel der Köpfe beträgt 90° [11].
Kurz nach Ausschüttung des Kalziums aus dem Sarkoplasmatischen Retikulum, setzt der aktive Rücktransport (unter Verbrauch von ATP) ein [18]. Ist der Kalziumspiegel noch hoch genug um das Troponin-C zu sättigen (>1
Die Myosinfilamente eines Sarkomers sind versetzt zueinander angeordnet:

Abb. 3.1.4: Anordnung der Aktin- und Myosinfilamente im Sarkomer. Auf Grund der unterschiedlichen Überlappung der Aktin- und Myosinfilamente, hängt die Kraft eines Muskels von der mittleren Länge seiner Sarkomere ab. Entnommen aus [29].
Da die Kontraktionskraft des Muskels von der Anzahl der über die Aktinfilamente gleitenden Myosinköpfchen abhängt, ist sie eine Funktion von der Sarkomerlänge:

Abb. 3.1.5: Sarkomerlängen-Kraft-Beziehung. Die Kraft des Muskels hängt von der Länge seiner Sarkomere ab. Im Bereich der maximalen Kraft (a) überlappen alle Myosinköpfchen mit den Aktinfilamenten. Wird der Muskel stärker gedehnt, so nimmt die Überlappung und somit die Muskelkraft linear mit der Sarkomerlänge ab (c). Bei geringer Sarkomerlänge stoßen die Aktinfilamente der gegenüberliegenden Z-Scheiben aneinander bzw. überlappen sich und behindern so die Bewegung (b). Entnommen aus [23].
In Skelettmuskeln findet man drei verschiedene Muskelfasertypen, die sich vor allem in ihrem Gehalt an Myoglobin, Enzymen des oxidativen bzw. glykolytischen Energiestoffwechsels und der Aktivität der Myosin ATP-ase unterscheiden [23]:
Die langsamen, myoglobinreichen (daher roten) Fasern vom Typ-I findet man hauptsächlich in Haltemuskeln (z.B. Rumpfmuskulatur, M. soleus der Waden). Sie sind besonders gut geeignet für energiesparende unermüdliche Haltearbeit.
In schnell kontrahierenden weißen Muskeln findet man vorwiegend Typ-IIA und Typ-IIB Fasern. Die Aktivität ihrer Myosin-ATPase ist höher als die der Typ-I Fasern. Dafür ermüden sie schneller, vor allem die Typ-IIB Fasern.
Auf Grund des Alles-oder-Nichts-Gesetzes für Muskelfasern variiert die Kraft einer motorischen Einheit bei einer Einzelzuckung nur wenig. Die Gesamtkraft des Muskels wird auf zweierlei Weise gesteigert [23]:
Tetanus
Die Erhöhung der Stimulationsfrequenz verstärkt die Kontraktion der gereizten motorischen Einheiten (durch die Erhöhung der intrazellulären Kalziumkonzentration.).
Reizstärke und Reizdauer
Durch Erhöhung der Reizstärke oder der Reizdauer werden mehr motorische Einheiten rekrutiert und so die Kontraktion verstärkt:

Abb. 3.1.6: Zusammenhang zwischen Pulsdauer und Schwellenintensität eines Nerven. Entnommen aus [6].
Je nach Versuchsanordnung wird zwischen folgenden elementaren Kontraktionsformen unterschieden [23]:

Abb. 3.1.7: Elementare Kontraktionsformen: Die isotonische- (A), die isometrische- (B) und die Unterstützungskontraktion (C). Modifiziert nach [23].
Bei isotonischer Kontraktion erfährt der Muskel eine konstante Gegenkraft durch ein Gewicht. In Ruhe wird er durch das Gewicht vorgedehnt. Bei der Kontraktion verkürzen sich die Sarkomere und führen so zur Kontraktion des Muskels (-> Abb. 3.1.7 A).
Bei der isometrische Kontraktion wird der vorgedehnte Muskel auf einer konstanten Länge gehalten (-> Abb. 3.1.7 B). Die äußere Spannung, die der Muskel erfährt, ergibt sich aus der Summe der Vorspannung und der aktiven Muskelkraft, die er entwickelt. Obwohl sich die Sarkomere bei dieser Kontraktion praktisch nicht verkürzen, erzeugt der Muskel eine aktive Spannung auf Grund der Querbrückenbildung zwischen den Aktin- und Myosinfilamenten.
Bei der Unterstützungskontraktion wird die Vordehnung des Muskels durch einen geeigneten Anschlag verhindert (-> Abb. 3.1.7 C). Der Muskel spannt sich zu Beginn der Kontraktion so lange isometrisch an, bis die Muskelkraft der Gewichtskraft gleich ist. Danach kontrahiert er isotonisch. Diese Kontraktionsform kommt der natürlichen Bewegung des Muskels am nächsten.
Bei der Kontraktion der Muskelfasern wird die Kraft über intramuskuläre elastischen Strukturen auf die Sehnen (bzw. beim isolierten Muskel auf die Messvorrichtung) übertragen. Vereinfacht kann man sich einen Muskel als ein Modell aus kontraktielen Elementen, parallelelastischen - und serienelastischen Elementen vorstellen [23]:

Abb. 3.1.8: Analogmodell eines Skelettmuskels: (A) in Ruhe und (B) während isometrischer Kontraktion. KE kontraktieles Element, SE serienelastischen Element, PE parallelelastisches Element.
Die serienelastischen Strukturen sind zum Teil in den Querbrücken, teilweise in den Aktinfilamenten, in den Z-Scheiben und in den Sehnenansätzen lokalisiert [23]. Indem sich bei isometrischer Aktivierung des Muskels die kontraktielen Elemente um ca. 1% verkürzen, werden die serienelastischen Strukturen gespannt, und es kommt zu einer messbaren Muskelkraft (-> Abb. 3.1.8).
Die parallelelastischen Elemente werden u.a. vom Sarkolemm und den bindegewebigen Strukturen innerhalb des Muskels gebildet.
3.2 Herzmuskulatur
Der Herzmuskel ist, ähnlich wie der Skelettmuskel, gestreift, was eine sehr ähnliche Organisation von Actin- und Myosinfilamenten widerspiegelt. Im Unterschied zur Skelettmuskulatur ist die Herzmuskulatur (wie die glatte Muskulatur) Teil des autonom-vegetativen Systems und nicht willkürlich zu beeinflußen.
Die Umwälzpumpe des Blutkreislaufes, das Herz, hat die Aufgabe, den Blutdruck aufzubauen, bzw. aufrecht zu erhalten. Es setzt sich aus zwei Hohlorganen zusammen, der rechten und der linken Herzhälfte:
Die rechte Hälfte ist Teil des sogenannten Niederdruckkreislaufes. Über die V. carva wird das venöse Blut des Körpers ins rechte Herz eingeleitet und über die A. pulmonalis in die Lungen gepumpt.
Durch die V. pulmonalis tritt das nun sauerstoffangereicherte Blut in die linke Herzhälfte ein und wird schließlich über die Aorta in die Arterien des Körpers gepumpt.
Die Pumpwirkung erfolgt durch rhythmischen Wechsel von Erschlaffung (Diastole) und Kontraktion (Systole) des Herzens.

Abb. 3.2.1: Fronntalansicht des eröffneten Herzens mit den großen angeschlossenen Gefäßen. Die Richtung der Blutströmung ist durch Pfeile gekennzeichnet. (1) Aorta, (2) linker Vorhof, (3) linke Kammer, (4) rechte Kammer, (5) rechter Vorhof und (6) A.pulmonalis. Entnommen aus [23].
Beide Herzhälften bestehen aus einem Vorhof und einer Kammer. Um den Bluttransport zu ermöglichen, befinden sich zwischen Vorhöfen und Kammern und zwischen Kammern und ausführenden Arterien jeweils Herzklappen:
Die AV-Klappen (Trikuspidalklappe beim rechten und Mitralklappe beim linken Herz) befinden sich zwischen den Vorhöfen und den Herzkammern. Sie verhindern einen Rückfluß des Blutes aus den Kammern in die Vorhöfe.
Die Pulmonalklappe und die Aortenklappe befinden sich an den Wurzeln der großen Arterien und verhindern das Rückströmen des Blutes in die Herzkammern während der Diastole.
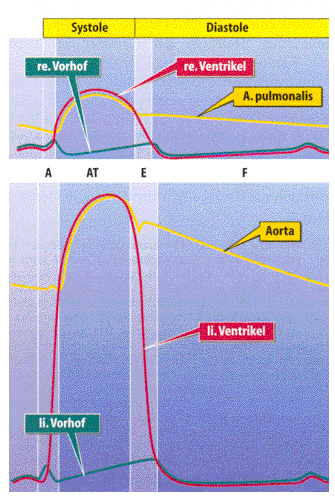
Abb. 3.2.2: Druckverläufe in den beiden Herzhälften und in den angeschlossenen großen Gefäßen während eines Herzzyklus. A=Anspannung, AT=Austreibung, E=Entspannung, F=Füllung. Entnommen aus [23].
Der Funktionszyklus des Herzens verläuft in vier Phasen:
Zu Beginn der Anspannungsphase erhöht sich der Druck in den Herzkammern, welches zum Schließen der AV-Klappen führt. Da die Arterienklappen zunächst noch geschlossen sind, kontrahiert sich das Herz isovolumetrisch und der Druck innerhalb der Ventrikel steigt schnell an. Die Dauer dieser Phase beträgt unter Ruhebedingungen etwa 60ms.
Wenn der intraventrikuläre Druck den diastolischen Druck der Arterien übersteigt, öffnen sich die Taschenklappen und die Austreibungsphase beginnt. Der Ventrikeldruck nimmt zunächst noch etwas zu und fällt dann gegen Ende der Systole wieder ab.
In der Entspannungsphase nimmt der ventrikuläre Druck aufgrund der isovolumetrischen Erschlaffung des Herzens schnell ab. Beim Unterschreiten des Vorhofdruckes öffnen sich die AV-Klappen.
Durch die Füllung des Herzens während der Füllungsphase nimmt der Druck innerhalb der Vorhöfe langsam zu.
Die Beeinflussung der Herzaktivität geschieht über das vegetative System. Das Herz ist von Nerven des Sympatikus und des Parasympatikus innerviert [23]:
Parasympatische Innervation - Das Herz ist durch den Nervus vagus hauptsächlich im Bereich des Sinus- und des AV-Knotens parasympatisch innerviert. Die Kammern sind weniger stark innerviert. Hier dominiert die antagonistische Wirkung von ACh auf die sympatischen Nervenendungen.
Sympatische Innervigtion - Die Nervenendungen des Sympatikus sind nahezu gleichmäßig über das Herz verteilt. Die Sympatikus Wirkung wird außerdem durch Katecholamine des Nebennierenmarks über das Blut vermittelt.
Afferente Nerven - Neben den efferenten Nerven ist das Herz auch mit afferenten Nerven versorgt, welche die mit Mechanosensoren verbunden sind: B-Sensoren (passive Dehnung) und A-Sensoren (aktive Spannung).
Die Herzmuskulatur unterscheidet sich in Aufbau und Physiologie von der Skelettmuskulatur des Bewegungsapparates und der glatten Muskulatur der Eingeweide und Gefäße.

Abb. 3.2.3: Diagramm eines Herzmuskels, wie er mit dem Lichtmikroskop (oberer Bildteil) und mit dem Elektronen-Mikroskop (unterer Bildteil) zu sehen ist. N bezeichnet die Zellkerne der Herzmuskelzelle bzw. des Endothels der Kapillare. Entnommen aus [20].
Hintereinander geschaltete Herzmuskelzellen bilden eine Herzmuskelfaser. Sie sind von einer gemeinsamen sarkolemmalen Hülle umgeben, der Perimembran. Die Herzmuskelzellen sind über niederohmige Kontaktflächen, die Glanzstreifen (Disci intercalares), miteinander verbunden, so daß die Erregung ohne Abschwächung auf die Nachbarzellen übertragen wird. Auf diese Weise bildet das Herz ein funktionelles Synzytium.
Wie bei allen Muskeltypen, so wird auch beim Herzmuskel die Kontraktion durch eine Erhöhung der intrazellulären Ca2+-Konzentration ausgelöst. Man findet im Herzen im wesentlichen die gleichen Strukturelemente wie im Skelettmuskel [23]:
Das transversale Tubulussystem (T-System), das Kalzium aus dem Extrazellulärraum ins Innere der Muskelzellen leitet, ist besonders im Ventrikelmyokard deutlich entwickelt.
Das sarkoplasmatische Retikulum ist dagegen im Vergleich zum Skelettmuskel schwächer ausgeprägt.
Im Sinus- und AV-Knoten des Herzens befinden sich spezielle Zellen, in denen das Ruhepotential nicht konstant ist. Nach einer Repolarisation kommt es in diesen Automatiezentren zu einer spontanen diastolischen Depolarisation und zur Auslösung eines Aktionspotentials. Dieses wird über das Erregungsleitungssystem weitergeleitet und breitet sich, da die Myokardzellen nicht gegeneinander isoliert sind, über die Glanzstreifen fächerförmig auch über die gesamte Arbeitsmuskulatur aus, was schließlich zu einer synchronisierten Kontraktion des gesamten Herzmuskels führt.

Abb. 3.2.4: Schema des Erregungsbildungs- und leitungssystems in einem Frontalschnitt des Herzens. (1) Sinusknoten, (2) AV-Knoten, (3) His-Bündel, (4) rechter Schenkel, (5) linker Schenkel, (6) anteriorer Faszikel, (7) posteriorer Faszikel, (8) Purkinje Fäden. Entnommen aus [23].
Das Erregungsleitsystem dient dazu den zeitlichen Ablauf der Kontraktion von Vorhöfen und Kammern zu koordinieren [23]:
Normalerweise wird die Erregung in dem (im rechten Vorhof befindlichen) Sinusknoten ausgelöst. Er treibt das Herz in Ruhe mit einer Frequenz von etwa 60-90 Schlägen/min an.
Danach breitet sich die Erregung über das Arbeitsmyokard der beiden Vorhöfe innerhalb von ca. 100ms aus.
Der Atrioventrikular-Knoten besitzt ebenso wie der Sinusknoten Schrittmacherzellen, die in der Lage sind das Herz rythmisch zu erregen. Er kann bei Ausfall der Erregungsbildung im Sinusknoten dessen Funktion übernehmen (potentieller Schrittmacher). Aufgrund der niedrigeren Erregungsfrequenz von etwa 40-60 Schlägen pro Minute wird die Erregungsweiterleitung durch die Frequenz des Sinusknotens überlagert und somit synchronisiert. Die Überleitung wird im AV-Knoten um ca. 90 ms verzögert.
Da die Grenze zwischen Vorhöfen und Kammern aus unerregbarem Bindegewebe besteht, erfolgt die Erregung der Kammern durch ein spezielles Erregungsleitungssystem, dem Hisbündel, das sich in je einen Bündelschenkel für jede Kammer verzweigt.
In den anschließenden Purkinje-Fäden wird die Erregung schnell weiter geleitet (2m/s), so daß die verschiedenen Regionen der Kammern nahezu gleichzeitig kontrahieren. Sie wirken außerdem aufgrund ihrer langen Aktionspotentialdauer als ein zwischen Vorhöfe und Kammern geschalteter Frequenzfilter für zu hohe Erregungsfrequenzen.
Das Herz muß sich wechselnden Anforderungen an den Kreislauf, beispielsweise bei körperlicher Belastung, durch Änderung der Pumpleistung anpassen. Bei Messung der Herzaktivität wird unterschieden zwischen: Stärke der Kontraktionskraft (Inotropie), Geschwindigkeit der Erregungsbildung in den Automatiezentren (Chronotropie), Erregungsleitung im Herzen (Dromotropie) und Erregbarkeit der Herzmuskulatur (Bathmotropie).
Wie beim Skelettmuskel löst auch bei der Herzmuskulatur das Aktionspotential die Kontraktion aus. Die Verknüpfung von Erregung und Kontraktion des Herzens unterscheidet sich jedoch sehr von der des Skelettmuskels [23]:
Das Aktionspotential des Herzens ist viel länger als das des Skelettmuskels (200-400 ms). Charakteristisch für die Aktionspotentiale des Herzens sind die lange Plateauphase, die durch einen depolarisierenden langsamen Ca2+-Einstrom (auf Grund der verzögert einsetzenden und langsam abklingenden Öffnung von iCa-Kanälen) und eine Verminderung des repolarisierenden K+-Auswärtsstroms (durch Verminderung der K+-Leitfähigkeit der gK1-Kanäle) erzeugt wird.
Während die Kontraktion des Skelettmuskels einsetzt, wenn die Erregung praktisch schon zu Ende ist, findet man im Myokard eine weitgehende Übereinstimmung beider Abläufe.
Das Herz hat eine langandauernde Refraktärzeit, in der das Myokard nicht bzw. vermindert erregbar ist. Sie schützt das Herz vor einer zu schnellen Neuerregung und somit vor Verminderung der Pumpwirkung. Außerdem wird so die Wahrscheinlichkeit des Eintretens der Erregung in Bereiche, die wieder erregbar sind, verhindert.
Auf Grund der langen Aktionspotentialdauer und der langen Refraktärzeit ergibt sich die Tatsache, daß die Herzmuskulatur nicht wie die Skelettmuskulatur tetanisierbar ist.
Da das Herz ein funktionelles Synzytium ist, kann die Regulierung der Kontraktionskraft nicht über die Rekrutierung unterschiedlich vieler motorischer Einheiten wie beim Skelettmuskel gesteuert werden.
Die Kontraktion des Herzmuskels ist dafür über den Erregungsvorgang und über direkte Eingriffe in die elektromechanische Kopplung beeinflußbar:
Parasympatikuswirkung
Der Neurotransmitter des Parasympatikus ist Acetylcholin. Die Erhöhung der ACh-Konzentration führt zu einer Erhöhung der K+-Leitfähigkeit durch Öffnung der ACh-gesteuerten K+-Kanäle und evtl. zu einer direkten Hemmung der Ca2+-Leitfähigkeit. Durch die Erniedrigung der intrazellulären Ca2+-Konzentration wirkt ACh negativ inotrop.
Außerdem wird die Steilheit der diastolischen Depolarisation der Schrittmacherzellen vermindert. Dieses führt zu einem negativ chronotropen Effekt.
Acetylcholin verlangsamt die atrioventrikuläre Überleitung und wirkt so negativ dromotrop.
Atropin hemmt die Acetylcholinwirkung durch Blockierung der muskarinischen ACh-Rezeptoren.
Sympatikuswirkung
Die Katecholamine wirken über die Beta-Rezeptoren des Herzens. Noradrenalin, der postganglionäre Neurotransmitter des Sympatikus und Adrenalin aus den Nebennieren führen zu einer Verstärkung des langsamen Ca2+-Einstroms und wirken so positiv inotrop.
Außerdem erhöhen die Katecholamine die Steilheit der diastoloschen Depolarisation der Schrittmacherzellen des Sinus-Knotens und wirken auf diese Weise positiv chronotrop.
Die atrioventrikuläre Überleitung wird durch die Katecholamine beschleunigt. Sie wirken also positiv dromotrop.
Betablocker (z.B. Propranolol) hemmen die Wirkung der Katecholamine auf das Herz.
Herzglykoside
Diese Substanzen wirken über die Hemmung der Na+-K+-ATPase Aktivität. Dieses führt zu einem intrazellulären Na+ Anstieg. Dadurch wird weniger intrazelluläres Ca2+ gegen extrazelluläres Na+ ausgetauscht und somit die Kontraktionskraft des Herzens verstärkt.
Kalzium-Kanal-Blocker
Verapamil reduziert den Ca2+-Einstrom in die Zelle und wirkt somit negativ inotrop [21].
Ionenmilieu
Veränderungen des Ionenmillieus des Herzens haben ebenso einen Einfluß auf die Funktion des Herzens. Erhöhung der K+-Konzentration führen zu einer Erniedrigung des Ruhepotentials und zur Erhöhung der K+-Leitfähigkeit der Zellmembran. Dadurch nehmen Erregbarkeit, Leitungsgeschwindigkeit und die Dämpfung heterotoper Automatiezentren zu.
Sehr hohe Konzentrationen reduzieren jedoch Leitungs-Geschwindigkeit, Erregbarkeit und Kontraktionskraft des Herzens.
Niedrige Konzentrationen fördern Herzrythmusstörungen durch Verstärkung der Automatie des AV-Knotens.
Durch Dehnung des Herzens wird die Ca2+-Empfindlichkeit des kontraktilen Apparates erhöht (Frank Sterling Mechanismus) [22].
3.3 Glatte Muskulatur

Abb. 3.3.1: Modell einer glatten Muskelzelle. Bei diesem hypothetischen Bild sind kontraktile Filamentbündel aus Aktin und Myosin an dichten Stellen der Plasmamembran verankert und am anderen Ende über dichte Knotenstellen im Cytoplasma mit nicht-kontraktilen Intermediär-Filamenten verbunden. Entnommen aus [29].
Der Muskel, der den Nicht-Muskelzellen am ähnlichsten ist, hat im Gegensatz zu den beiden anderen Muskeltypen keine Streifung und wird aus diesem Grunde als glatter Muskel bezeichnet.
Auch funktionell unterscheidet sich dieser Muskeltyp sehr von den beiden anderen.
Entsprechend der unterschiedlichen funktionellen Anforderungen an die glatten Muskeln in den verschiedenen Organen, findet man eine große Mannigfaltigkeit in der Struktur dieser Muskelgruppe.
Strukturell und funktionell werden die glatten Muskeln in zwei Haupttypen eingeteilt [23]:
Beim Single-Unit-Typ sind die Muskelzellen durch gap junctions elektrisch miteinander gekoppelt, so daß sie eine funktionelle Einheit, vergleichbar mit dem funktionellen Synzytium des Herzens, bilden.
Die Erregung entsteht autonom innerhalb des Verbandes der Muskelzellen (in Schrittmacherzellen, ähnlich wie beim Herz) und breitet sich über den gesamten Muskelzellverband aus. Diese Aktivität wird durch vegetative Nervenfasern, hormonelle Einflüsse und mechanische Dehnung moduliert.
Auf Grund dieser myogenen Automatie sind sie z.T. spontan rythmisch aktiv (-> Abb. 6.2.1).
Zu diesem Muskeltyp zählen u.a. Magen- und Darmmuskulatur und die Muskulatur von Uterus und Ureter. Auch die Muskulatur der kleinen Blutgefäße gehört dazu.
Die Muskeln des Multi-Unit-Typs sind weniger autonom und stehen stärker unter der Kontrolle vegetativer Nerven: neurogener Tonus (-> Abb. 6.2.2). Ihnen fehlen weitgehend die gap junctions, wodurch die Erregung auf die jeweilige "motorische Einheit" beschränkt ist.
Zu dieser Gruppe zählen die Muskeln der meisten Blutgefäße, der Iris und des Ziliarkörpers.
Neben diesen zwei Haupttypen gibt es Übergangsformen, bei denen sich eine strenge Zuordnung zu einem der beiden Typen nicht machen läßt.
Die Kontraktion von glatten Muskeln geschieht, wie bei den beiden anderen Muskeltypen, durch teleskopartiges Übereinanderschieben der Aktin- und Myosinfilamenten.
Die Filamente sind im Unterschied zur gestreiften Muskulatur nicht in Myofibrillen angeordnet, sondern bilden einen mehr oder weniger geordneten kontraktilen Apparat (-> Abb. 3.3.1). Dieser ist grob an der Längsachse der Zelle ausgerichtet, aber an scheibenartigen Verbindungen schief an die Zellmembran angeheftet [29]. Auf diese Weise werden Gruppen von Zellen miteinander verknüpft.
Die Zellen der glatten Muskulatur weisen kleine Einstülpungen in der Zellmembran auf, ein typisches T-System ist aber nicht zu erkennen.
Das sarkoplasmatische Retikulum zur Speicherung von Kalzium-Ionen ist teils spärlich, teils ebenso voluminös wie im Skelettmuskel ausgebildet [29].
Das glattmuskuläre System dient (zusammen mit Herz- und Atmungs-Muskulatur) der Ausführung von Bewegungen im autonom-vegetativen System.
Die Kontraktion glatter Muskulatur ist im Vergleich zur schnellen Skelettmuskulatur 100-1000 mal langsamer [23]. Dafür können sie aber, bei einem 100-500 mal kleineren Energieaufwand, eine höhere Kraft entwickeln (bezogen auf einen gemeinsamen Muskelquerschnitt) [23]. Die glatte Muskulatur ist also besonders geeignet unermüdliche, energiesparende Haltefunktion (z.B. in den Gefäßen) zu leisten.
Die Sparsamkeit und Langsamkeit beruhen auf dem geringeren Gehalt an Myosin (etwa fünfmal weniger als in quergestreiften Muskeln) und der extrem niedrigen ATPAse-Aktivität [23].
Wie bei allen Muskeln so führt auch bei glatten Muskeln eine Erhöhung der intrazellulären Kalzium-Konzentration (von etwa 0.1
µmol/l auf 0.5-1.0 µmol/l) zur Kontraktion der Muskelzelle. Die Erhöhung wird auf zweierlei Weise ausgelöst [23]: Durch elektrische Potentialänderungen der Zellmembran (Aktionspotentiale oder länger andauernde Depolarisation) werden spannungsabhängige Kalziumkanäle geöffent, so daß Kalzium aus dem Extrazellulärraum in das Zellinnere strömt (elektro-mechanische Kopplung). Die Potentialänderungen werden neurogen, oder myogen ausgelöst.
Die elektro-mechanische Kopplung führt eher zu phasischen Kontraktionen.
Bei der Erregung durch Pharmaka, Neurotransmitter oder Hormone, die keine Veränderung des Membranpotentials bewirken spricht man von pharmako-mechanischer Kopplung.
Die Reaktion des Agonisten auf spezifische Rezeptoren der Membranwand bewirken die Öffnung von Kalziumkanälen oder die Bildung des intrazellulären Botenstoffes Inositoltrisphosphat (IP3). Dieser veranlaßt die Freigabe von Kalzium aus dem Sarkoplasmatischen Retikulum.
Bei der Bildung von IP3 eintsteht DAG, welches Proteinkinase C aktiviert. Diese löst (auch ohne Kalzium-Freisetzung) eine langanhaltende tonische Kontraktion aus.
Im Unterschied zur quergestreiften Muskulatur wird die Kontraktion der glatten Muskelzelle nicht über den Troponin-Tropomyosin-Komplex, sondern durch Phosphorylierung einer der beiden leichten Myosinketten, eingeleitet [29]:
Calmodulin fungiert in diesem Zelltyp als Kalziumschalter. Bei hinreichender Ca2+-Konzentration aktiviert der Kalzium-Calmodulin-Komplex die Myosin-Leichtketten-Kinase. Diese überträgt ein Phosphation von ATP auf eine der beiden leichten Myosinketten, welche auf diese Weise aktiviert wird und dazu neigt am Aktinfilament zu binden.
Da die Phosphorylierung sehr langsam vonstatten geht (bis zu einer Sekunde) und auch die Hydrolysierung des ATPs etwa 10mal langsamer als im Skelettmuskel erfolgt, kontrahiert der glatte Muskel viel langsamer als ein Skelettmuskel. Besonders bei langanhaltenden tonischen Kontraktionen wird der Myosinkopf-Ruderschlag auf diese Weise drastisch verlangsamt. Entsprechend niedriger ist der Energieverbrauch des Muskels.
Bei der Relaxation des Muskels wird der intrazelluläre Ruhe-Kalzium-Spiegel durch verschiedene Mechanismen wieder hergestellt [23]:
Durch ATP-getriebene Pumpen der Zellmembran oder durch Natrium-Kalzium-Austausch wird das Kalzium wieder in den Extrazellulärraum befördert.
Die Aktivierung des Sarkoplasmatischen Retikulums durch den second messager cAMP, wird Kalzium wieder in dieses zurückgepumpt.
Die Aktionspotentiale der Muskeln vom Single-Unit-Typ werden nicht durch Nervenimpulse, sondern von Schrittmacherzellen, ähnlich wie im Herzen, ausgelöst. Die Schrittmacherpotentiale depolarisieren die Zellmembran. Der darauf eintretende Kalzium-Einstrom führt für einige Millisekunden zur Umpolarisierung.
Über die gap junctions (niederohmige Zellkontakte) breiten sich die Aktionspotentiale auf die Nachbarzellen aus.
Durch Salven von Aktionspotentialen wird, ähnlich wie beim Tetanus des Skelettmuskels, eine Verstärkung der Kontraktion erreicht - der myogene Tonus. Dieser nimmt mit der Frequenz der Aktionspotentiale zu. Diese wird wiederum durch Hormone, Neurotransmitter und auch durch mechanische Dehnung moduliert.
Die Wirkung von ACh auf glatte Muskulatur wird hauptsächlich durch einen Rezeptor-Typ vermittelt [5]:
An den muskarinischen Rezeptoren wirkt ACh und Muskarin, das Fliegenpilzgift, erregend. Diese Rezeptoren befinden sich außer an den Zellmembranen der glatten Muskulatur auch im ZNS, an der Herzmuskulatur und anderen cholinergen, parasympatischen Zielorganen.
Atropin wirkt auf diese Rezeptoren kompetitiv hemmend.
Bei den Adrenozeptoren unterscheidet man die beiden Hauptgruppen der Alpha- und Beta-Rezeptoren, die wiederum in Untergruppen eingeteilt werden [5]:
Die Alpha1-Rezeptoren herrschen u.a. an den Speicheldrüsen und der glatten Muskulatur vor und führen zur Kontraktion von Artetiolen, Uterus, Bronchiolen, Sphinkter der Harnblase des Magen-Darm-Traktes und anderen. Als second messager fungiert der Botenstoff Inositoltrisphosphat (IP3).
Alpha2-Rezeptoren befinden sich u. a. im ZNS, Niere, Uterus, Parotis, Pankreas, Mastzellen, Trombozyten, sowie an manchen präsynaptischen Membranen (z.B. an cholinergen Neuronen des Magen-Darm-Traktes).
Über Beta1-Rezeptoren wird die intrazelluläre Kalzium-Konzentration von glatten Muskelzellen, Herz und Niere erhöht. Durch Stimulation dieser Rezeptoren kommt es i.a. zu einer Verstärkung der Kontraktion.
Die Stimulierung von Beta2-Rezeptoren führt im Gegensatz zu den Beta1-Rezeptoren zu einer Erniedrigung der intrazellulären Kalziumkonzentration und führt somit zur Entspannung des Muskels.
Auf die Alpha-Rezeptoren wirken vor allem Noradrenalin (NA) und Adrenalin (A), auf die Beta1-Rezeptoren vor allem NA, A und Isoproterenol (IPR) und auf die Beta2-Rezeptoren A und IPR, erregend.
3.4 Aufbau eines Skelettmuskelversuches
Der Versuch soll dazu dienen dem Studenten die elektrophysiologische Wirkungsweise eines Skelettmuskels zu veranschaulichen.

Abb. 3.4.1: Skizze des Skelettmuskel-Versuchsaufbaus. Nach [3] modifiziert.
Das in der Registrieranordnung (Transducer) hängende isolierte Nerv-Muskel-Präparat (Musculus gastrocnemius eines Krallenfrosches) wird durch Einzelimpulse oder Impuls-Salven des Stimulators zur Kontraktion angeregt. Die Rechteckimpulse des Stimulatros lösen an dem N. ischiadicus Aktionspotentiale aus, die zu Muskel-Kontraktionen führen. Die Reizschwelle des Nerves ist eine Funktion der Impulsdauer (-> Abb. 3.1.6). Da es bei diesem Versuch primär um Muskelphysiologie geht, wird die Impulsdauer während des gesamten Versuches auf einem konstanten Wert gehalten (z.B. 1ms). Die Anzahl der Reize, die Impulsdauer und die elektrische Spannung der Rechteckimpulse werden dagegen variiert und die Reaktionen des Muskels aufgezeichnet.
Der Transducer dient zur Aufnahme der mechanischen Spannungen und der Längenänderungen des Muskels. Diese werden über Messwandler, die in dem Transducer integriert sind, in elektrische Spannungswerte umgewandelt und auf einem Oszilloskop dargestellt.
Die Reizspannung wird ebenfalls mit dem Oszilloskop aufgezeichnet. Dieses dient einerseits der Kontrolle der Reizimpulse, andererseits können so die Reaktionszeiten des Nerv-Muskel-Präparates bestimmt werden.
In situ ist der Muskel immer etwas gespannt (vorgedehnt) und zieht sich aufgrund seiner elastischen Eigenschaften bei der Ablösung vom Knochen zusammen. Um unter physiologischen Bedingungen zu messen, muß der isolierte Muskel daher mit Hilfe von Gewichten vorgedehnt werden [26].
Nachdem die Reizschwelle des Nerv-Muskel-Präparates bestimmt ist, sollte mit deutlich übermaximalen Reizen gearbeitet werden, damit auch bei Veränderungen des Kontaktwiderstandes (z.B. durch Austrocknung) zu jeder Zeit sichergestellt ist, daß der Reiz eine maximale Zuckung auslöst [10].
Viel schneller als ein Muskel in situ zeigt ein isolierter Skelettmuskel aufgrund der fehlenden Durchblutung bei wiederholter Kontraktion deutliche Ermüdungserscheinungen, von denen er sich nicht in jedem Fall vollständig erholt [26]. Deshalb sollte darauf geachtet werden, daß der Muskel nicht schon zu Beginn des Versuches durch hohe Reizfrequenzen ermüdet wird. Aus diesem Grunde sollten die Einzelversuche in systematischer Reihenfolge durchgeführt werden:
Zuerst sollte die Reizstärkeabhängigkeit bestimmt werden, so daß im Folgenden nur noch mit supramaximalen Reizen gearbeit werden kann.
Danach werden die Versuchsteile durchgeführt, in denen mit Einzel- oder Doppelimpulsen gereizt wird.
Hierauf folgen die tetanischen Reizungen des Muskels.
Am Schluß stehen die Versuche, bei denen ganz bewußt eine Ermüdung herbeigeführt wird.
Der Muskel ist kein ideal elastisches Gebilde sondern verformt sich unter Umständen auch plastisch, d.h. irreversibel. Deshalb sollte darauf geachtet werden den Muskel nicht zu lange mit zu vielen Gewichten zu belasten [26].
Die Messwandler registrieren die Längen- und die Kraftänderung des Muskels und wandeln die Messungen in elektrische Spannungswerte um, die auf dem Oszilloskop angezeigt werden können. Um die angezeigten Spannungen in Längen- bzw. Krafteinheiten umzurechnen, muß zu Beginn des Versuches die Beziehung zwischen den Messgrößen und den Spannungswerten bestimmt werden. Dieses geschieht mit Hilfe bekannter Längen- bzw. Kraftmaße (Gewichte oder Federwaage).
3.5 Aufbau eines Glatte-Muskel-Versuches
Der Versuch soll die Motorik der Glatten Muskulatur von Blutgefäßen und Eingeweiden und den pharmakologischen Einfluß einiger Wirkstoffe verdeutlichen.

Abb. 3.5.1: Anordnung zur Messung der mechanischen Aktivität an einem isolierten glattmuskulären Präparat. Entnommen aus [10].
Um die Funktionalität der präparierten, glatten Muskelstreifen aufrecht zu erhalten, werden die Versuche im Organbad des doppelwandigen Versuchsgefäßes durchgeführt. Die in diesem Gefäß und im Vorratsgefäß befindliche Ringerlösung wird durch Glasfritten mit einem Gemisch aus 95% O2 und 5% CO2 begast. Mit Hilfe eines Thermostats wird die Wandung der Gefäße auf einer Temperatur von ca. 37°C gehalten.
Zur Untersuchung der Wirkung einiger Pharmaka auf die verschiedenen glatten Muskeln, werden diese in das Organbad pipettiert.
Ein Abflußstutzen am Boden des Versuchsgefäßes erlaubt das Auswechseln der Lösung.
Die Muskelpräparate werden an beiden Enden mit Bindfäden umschlungen und an einem Ende im Versuchsgefäß befestigt. Das andere Ende wird mit dem mechano-elektrischen Wandler verbunden. Dieser Messwandler registriert die Kontraktion des Muskels und gibt eine der Längenänderung proportionale Spannung aus.
Diese wird, nachdem sie ausreichend verstärkt wurde, mit Hilfe eines Papierschreibers aufgezeichnet.
3.6 Aufbau eines Herzmuskelversuches nach Langendorff
Das Langendorff'sche Präparat war bereits um die Jahrhundertwende von Physiologen und Pharmakologen als Methode zum Studium der Motorik der Herzmuskulatur und den pharmakologischen Einfluß von Wirksubstanzen allgemein akzeptiert.

Abb. 3.6.1: Einfache Anordnung zur Messung der mechanischen Aktivität eines isoliert perfundierten Herzens nach Langendorff. Der Perfusionsdruck kann durch Veränderung der Höhe (h) der auf dem Herzen stehenden Wassersäule verändert werden. Er wird so eingestellt, daß der Gesamtfluß durch das Herz konstant bleibt.
Das Herz wird über die Aorta mit sauerstoffreicher, 37° warmer Nährlösung retrograd perfundiert. Dabei schließen sich die Aortenklappen und die Flüssigkeit muß ihren Weg durch die Coronararterien nehmen. Nach Durchlauf des Coronargefäßsystems fließt das Perfusat aus dem Sinus coronarius bzw. dem eröffneten rechten Vorhof ab.
Der Gesamtdurchfluß durch das Herz kann entweder als "venöser" Ausfluß aus dem rechten Ventrikel (z.B. Tropfenzähler) oder als "arterieller" Zufluß oberhalb der Aortenkanüle gemessen werden. Zur Messung des zeitlichen Verlaufs des Coronarflußes mit Hilfe hochauflösender Flußmessverfahren, muß der Coronarsinus kanalisiert werden.
Das Experiment kann unter druckkonstanten oder flußkonstanten Bedingungen durchgeführt werden. Vom hämodynamischen Standpunkt aus ist der druckkonstanten Perfusion der Vorzug zu geben. Dagegen spricht für flußkonstante Messbedingungen, daß die in den Perfusatstrom applizierten Pharmaka nur auf diese Weise genau dosiert werden können und daß die Substratversorgung des Myokards genau eingestellt werden kann [8].
Durch Veränderung der Höhe der auf dem Herz stehenden Wassersäule (-> Abb. 3.6.1), wird der Perfusionsdruck verändert. Der Perfusionsdruck sollte nicht zu hoch eingestellt werden, da es sonst zur Insuffizienz der Aortenklappen kommen kann und größere Perfusatmengen in den linken Ventrikel einströmen. Dieses führt zu einer plötzlichen Erhöhung des diastolischen Druckes. Der kritische Perfusionsdruck hängt von der Tiergattung ab: Bei Ratten liegt er zwischen 145 und 200 mmHg, bei Meerschweinchen zwischen 80 und 130 mmHg [8].
Die Perfusion mit salinen Lösungen führt zu einer Ödembildung im Myokard und somit zur langsam fortschreitenden Abnahme der Kontraktionskraft. Aus diesem Grund sollte der Perfusionsdruck so gering wie nötig eingestellt werden: Bei Rattenherzen reichen 70-80mmHg (950-1100 mmWassersäule) bei Meerschweinchen 50-60mmHg (680-810 mmWassersäule). Durch Ödem-verhindernde Substanzen kann der Effekt weiter verringert werden [8].
Mit der Ballonmethode läßt sich der zeitliche Verlauf der Kontraktionskraft des linken Ventrikels isovolumetrisch als Druck messen. Dazu wird ein Ballonkatheter durch die V. pulmonales in das linke Ventrikel eingeführt. Da die Messung bei konstantem Volumen erfolgt, kann mit dieser Methode nicht die von dem Muskel verrichtete physikalische Arbeit gemessen werden. Zur Messung der verrichteten Herzarbeit sind etwas modifizierte Anordnungen zu verwenden:
In einer Variation der Ballonmethode sind am äußeren Ende des Karheters Ventile eingebaut, so daß sich der Ballon entsprechend dem Schlagvolumen entleeren und in der Diastole aus einem Reservoir wieder füllen kann [8].
Eine andere Methode ist die die zusätzliche Kanülierung des linken Vorhofs zwecks Zuleitung des Perfusats in den linken Ventrikel und dann in die Aorta, wobei das Perfusat den natürlichen Weg durch das Herz nimmt [8].
Bei diesen beiden Varianten wirft der linke Ventrikel - entsprechend der Vorlaßt - ein messbares Schlagvolumen gegen eine definierbare Nachlast aus und verrichtet somit Druck-Volumen-Arbeit.
4 Konzeption der Programme
Bei der Konzeption der virtuellen Labore wurde versucht die Realität so gut wie möglich zu simulieren. Die in den Kapiteln 3.4, 3.5 und 3.6 vorgestellten Entwürfe realer Versuchsumgebungen dienten dabei als Referenz.
4.1 Konzeption von SimMuscle
Mit dem Programm SimMuscle kann der Benutzer die Einflüsse verschiedener elektrischer Reizspannungs-Verläufe und Vordehnungen auf den Kontraktions- und Kraftverlauf eines Skelettmuskels experimentell erlernen.
4.1.1 Allgemeine Konzeption
Folgende Einzelversuche sind im Rahmen des Praktikums vorgesehen:
Eichung der Messwandler (-> Kapitel 6.1)
Bevor die Experimente am Muskel durchgeführt werden können, müssen die Messwandler geeicht werden.
Der Längenaufnehmer wird über ein an der Messappartur angebrachtes Lineal geeicht.
Der Kraftaufnehmer kann mit Hilfe von Gewichten geeicht werden.
Reizstärkeabhängigkeit der Muskelkontraktion
Zu Beginn des Versuches wird die Reizschwelle des Nerv-Muskel-Präparates bestimmt. Wie in Kapitel 3.4 erwähnt wurde, kann die Reizdauer eines Impulses auf einen Wert von z.B. 1ms festgelegt werden. Alle folgenden Versuche werden danach mit supramaximalen Reizen durchgeführt.
Superposition von Reizen
Dieser Versuchsteil veranschaulicht die Überlagerung der Zuckungen bei Doppelreizung des Muskels. Das Kontraktionsmaximum hängt von dem Reizabstand ab.
Tetanische Kontraktion
Durch Reizung des Muskels mit Salven schnell aufeinander folgender Impulse, verschmelzen die Einzelzuckungen zu einem Tetanus. Diese Kontraktionform ist die physiologisch relevante.
Ruhe-Dehnungskurve
Durch sukzessive Belastung des Muskels mit Gewichten erhält man die Ruhedehnungskurve. Die Kraft, die der Muskel auf Grund seiner Elastizität einer äußeren Kraft entgegensetzt, wird auch als passiver Anteil der Muskelkraft bezeichnet.
Kurve der isometrischen Maxima
Diese Kurve ist das makroskopische Analogon zur Sarkomerlängen-Kraft-Beziehung einer Muskelfaser und somit sehr wichtig für das Verständnis der Skelettmuskulatur.
Kurve der isotonischen Maxima
Im Gegensatz zur isometrischen Kontraktion - kann sich der Muskel bei der isotonischen Kontraktion verkürzen. Er verrichtet somit physikalische Arbeit, die in diesem Versuchsteil betimmt werden soll.
Verkürzungsgeschwindigkeit und Leistungskurve
Ebenso kann bei isometrischen Kontraktionen die Kurve der Verkürzungsgeschwindigkeit und aus dieser die Leistungskurve des Muskels bestimmt werden.
Für die Simulation des Versuches zur Messung der mechanischen Aktivität eines isolierten Skelettmuskel-Präparates werden folgende (virtuelle) Elemente benötigt:
Wie im realen Experiment sollten die eine Kontraktion bestimmenden Parameter eine Varianz haben und sich im Laufe des Versuches verändern (Ermüdung). Um dieses zu verdeutlichen, werden für die Versuche zwei Nerv-Muskel-Präparate mit verschiedenen Eigenschaften zur Verfügung gestellt, die sich jeweils im Laufe des Versuches verändern.
Der Muskel wird an beiden Enden in einer Haltevorrichtung befestigt - dem Transducer. Er dient einerseits zur Befestigung des Muskels bei isotonischen und isometrischen Kontraktionen, andererseits zur Umwandlung der Kraft- und Längenänderungen des Muskels in elektrische Signale.
Um den Einfluß der Vordehnung auf die Kraft, bzw.. Kontraktionsstärke des Muskels zu simulieren, wird er mit unterschiedlichen Gewichten vorgedehnt. Bei der isotonischen Kontraktion dienen die Gewichte zur Belastung des Muskels mit einer konstanten äußeren Kraft.
Ein Stimulator reizt den Nerv des Skelettmuskel-Präparates mit einzelnen Rechteckimpulsen oder Impuls-Salven. Wie bereits in Kapitel 3.4 erläutert, kann die Dauer eines Impulses während des gesamten Versuches konstant gehalten werden. Die Reizamplitude, die Impulsanzahl und der Abstand bzw. die Frequenz der Impulse werden dagegen variiert.
Das ideale Aufzeichnungsmedium für die schnell veränderlichen Mess-Spannungen ist ein Zwei-Kanal-Speicher-Oszilloskop. Mit diesem können Reiz- und Mess-Spannung gleichzeitig dargestellt werden.
Die Navigations-, bzw. Informations-Buttons sind am unteren Rand des Bildschirmes angebracht.

Abb. 4.1.1: Versuchsanordnung zur Simulation des Skelettmuskel-Versuches. Lnks oben befindet sich der Stimulator, links unten der Transducer (bestehend aus der Haltevorrichtung für den Muskel, integriertem Längen- und Kraftaufnehmer und entsprechenden Messwandlern). Auf der rechten Seite befinden sich das 2-Kanal-Speicher-Oszilloskop, die Gewichte und die Schüssel für die beiden Muskelpräparate. Am unteren Bildschirmrand sind die Buttons für die Navigation, Copyright-Information und Hilfe plaziert.
4.1.2 Konzeption der Elemente
Für die Versuche werden dem Anwender zwei Muskel zur Verfügung gestellt. Beide besitzen etwas unterschiedliche Eigenschaften, die bei jedem Programmstart neu festgelegt werden.

Abb. 4.1.2: Die zwei Muskelpräparate des Programms SimMuscle.
Ein- und Aushängen eines Muskels
Ein Muskel wird mit gedrückter Maustaste über den Bildschirm bewegt. Berührt er dabei die Haltevorrichtung des Transducers, so wird er in diese eingehängt.
Zum Aushängen eines Muskels wird er angeklicht und mit gedrückter Maustaste von der Haltevorrichtung wegbewegt.
Zur Fixierung des Muskels und zur Aufnahme seiner Längen- bzw. Kraftänderungen und Umwandlung der mechanischen Messwerte in elektrische Spannungen, dient der Transducer.
Mit einem Power-Schalter wird das Gerät ein- bzw. ausgeschaltet.
Über einen Knebelschalter kann die Muskellänge arretiert werden, um so isomerische Versuchsbedingungen zu erhalten (lock). Steht der Knebelschalter auf free läuft der Versuch isotonisch ab. Bei isometrischer Kontraktion wird die Muskelkraft, bei isotonischer Kontraktion die Längenänderung des Muskels gemessen und ausgegeben.
Falls die Haltevorrichtung für den Muskel beim Ein- bzw. Aushängen eines Gewichtes oder eines Muskels arretiert ist, wird sie kurzfristig (automatisch) gelöst. Dieses dient zur Erleichterung der Handhabung des Gerätes.
Der entsprechende elektrische Spannungswert liegt am rechten Ausgang (Force) des Gerätes an und kann durch Anschluß des offenen BNC-Kabels auf den zweiten Kanal des Oszilloskopes angezeigt werden. Bei isotonischen Versuchsbedingungen wird die Muskellänge gemessen - der Spannungswert liegt am linken Ausgang (Length) an.
Mit den Zero-Adjust-Schaltern können die Nullpunkte der Ausgangsspannungen festgelegt werden - das entsprechende Calibration-Lämpchen leuchtet grün, wenn keine Offset-Spannung anliegt, sonst rot.

Abb. 4.1.3: Der Transducer von SimMuscle.
Bedienung der Schalter des Transducers
Der Power-Schalter und der Knebelschalter der Arretierung wechseln bei jedem Klick zwischen zwei Zuständen hin und her (Ein-Aus, Lock-Free).
Die Zero-Adjust-Schalter werden beim Maus-Klick gedrückt und springen beim Loslassen der Maustaste wieder in den Ausgangszustand zurück.
Nach dem Start des Programmes ist der Transducer zunächst nicht an das Oszilloskop angeschlossen. Durch Drücken der Maustaste wird das BNC-Kabel, welches mit einem Eingang des Oszilloskopes verbunden ist, im Bereich des Steckers "gegriffen". Der Mauscursor nimmt die Form eines Rechteckes an, das bei gedrückter Maustaste über den Bildschirm bewegt wird. Berührt es einen der Transducer-Ausgänge, so wird das BNC-Kabel an diesen Ausgang angeschlossen:

Abb. 4.1.4: Die Verkabelung eines der beiden Ausgänge des Transducers mit dem am Oszilloskop angeschlossenen BNC-Kabel. Wird das Kabel mit der Maus "gegriffen", so erscheint ein Rechteck an der Cursorposition. Berührt dieses einen der Ausgänge, so wird dieser mit dem Oszilloskop verbunden. Beim Loslassen der Maustaste verschwindet das Rechteck wieder.
Sechs Gewichte zu je 50g stehen dem Anwender, zur Vordehnung und isotonischen Belastung der Muskel, zur Verfügung. Sie können nach und nach an den Muskel gehängt werden.

Abb. 4.1.5: Die sechs Gewichte zur Vordehnung und isotonischen Belastung des virtuellen Muskels in SimMuscle.
An- und Abhängen der Gewichte
Jedes Gewicht wird mit gedrückter Maustaste über den Bildschirm bewegt. Berührt es dabei den Muskel, oder die Aufhängung, wird es an die vorgesehene Öse bzw. an das zuletzt eingehängte Gewicht gehängt.
Zum sukzessiven Abhängen der Gewichte werden sie mit der Maus angeklicht und mit gedrückter Maustaste von dem Muskel wegbewegt.
Muskel und Gewichte können unabhängig voneinander in den Transducer ein- bzw. ausgehängt werden, da sie an der Öse des Längenaufnehmers befestigt werden und nicht direkt miteinander verbunden sind.
Wie im realen Experiment, so dient der virtuelle Stimulator in SimMuscle dazu, das Nerv-Muskel-Präparat mit elektrischen Rechteck-Impulsen zu reizen.
Mit dem Power-Schalter wird das Gerät ein- bzw. ausgeschaltet.
Zwei Schieberegler dienen dazu die Amplitude der Impulse (Amplitude) bzw. den zeitlichen Abstand aufeinanderfolgender Impulse (Delay) einzustellen. Um die Einstellung zu erleichtern, werden die eingestellten Werte digital angezeigt.
Mit dem Mode-Schalter wird die Anzahl der Impulse eingestellt. Im Single-Betrieb wird ein Impuls, im Twin-Betrieb zwei und im Train-Bertieb bis zu 199 Impulse erzeugt. Die Anzahl der Impulse im Train-Mode kann über ein dreistelliges Zählwerk (Counts) eingestellt werden.
Der Stimulus-Schalter löst den Einzelimpuls (bzw. eine Folge von Impulsen) aus.
Mit Hilfe des Reset-Knopfes kann die Reizsequenz, z.B. bei unerwünscht langer Stimulations-Dauer oder bei Fehlbedienung des Gerätes, jederzeit unterbrochen werden.
Am linken und mittleren Spannungs-Ausgang des Gerätes (Stim. out) liegt das Reiz-Signal an. Der linke Ausgang ist mit dem Nerven des Präparates verbunden; der Mittlere dient zur Darstellung der Reizspannung auf dem Oszilloskop. Der rechte Ausgang (Trig. out) ist mit dem externen Triggereingang des Oszilloskopes verbunden. Der Stumulator liefert nach jedem Betätigen des Stimulus-Schalters einen (einzelnen) Triggerimpuls, um die Aufzeichnung auf dem Oszilloskop zu starten.

Abb. 4.1.6: der Stimulator von SimMuscle.
Bedienung der Schalter Ein Maus-Klick auf den Power-Schalter schaltet das Gerät ein bzw. aus.
Die Single-Twin-Train-Schalter sind miteinander verbunden. Das Betätigen eines Schalters löst den zuvor gedrückten wieder. Der aktivierte Schalter wird durch Aufleuchten hervorgehoben.
Der Stimulus- und der Reset-Schalter springen kurz nach Betätigung automatisch wieder in den Ausgangszustand zurück.
Die Schalter des Zählwerkes werden nicht animiert, da die Reaktion des Programms auf die Anwender Aktion durch Veränderung der Zahlenwerte ausreichend signalisiert wird.
Die Anzeigenadeln der Schieberegler werden mit gedrückter Maustaste horizontal verschoben. Um sie während der Bewegung nicht durch den Maus-Cursor zu verdecken, wird dieser solange unsichtbar gemacht.
Die schnellen zeitlichen Verläufe der Mess-Spannungen werden mit Hilfe eines Oszilloskopes aufgezeichnet.
Zur Synchronisierung der Aufzeichnung mit der Reizkurve wird es durch einen Triggerimpuls des Reizgerätes extern getriggert. Auf interne Triggerung des Gerätes kann somit verzichtet werden.
Das Oszilloskop wird normalerweise im sog. Continuous-Modus betrieben. Im Unterschied zum Single-Sweep-Modus, bei dem der Elektronenstrahl immer nur einen Durchlauf macht, wird der Spannungsverlauf im Continuous-Mode continuierlich dargestellt. Dabei wird die Aufzeichnung nach Erreichen der rechten Seite des Oszilloskop-Screens wieder am Anfang des Screens fortgesetzt. Auf diese Weise ist es möglich auch längere Messungen mit einer hohen Zeitauflösung aufzuzeichnen, um die Kurve besser zu erkennen und langsame zeitliche Verläufe, z.B. Ermüdungserscheinungen, besser darzustellen.
Wie die beiden anderen Geräte, wird das Gerät mit einem Power-Schalter ein- und ausgeschaltet.
Die Drehschalter Channel-1 und Channel-2 bestimmen die vertikale Auflösung der aufgezeichneten Spannungskurven, der Timebase-Drehschalter die zeitliche Auflösung.
Mit den beiden Schiebereglern (CH1, CH2) am linken Rand des Oszilloskop Screens können die vertikalen Offsets der Kurven verändert werden, um sie auf dem Screen optimal zu positionieren.
Der Store-Schalter wechselt in den Speichermodus - alle nachfolgenden Kurven werden übereinander gezeichnet und können so auf komfortable Weise miteinander verglichen werden. Mit dem Clear-Screen-Schalter wird der Bildschirm gelöscht.
Der Single-Sweep-Schalter löst einen einzelnen Durchlauf des Elektronenstrahls aus. Er kann dazu verwendet werden einen Spannungs-Offset (z.B. beim Eichen des Messwandlers) zu messen.

Abb. 4.1.7: Das 2-Kanal-Speicher-Oszilloskop von SimMuscle.
Bedienung der Schalter
Der Power-Schalter funktioniert wie der des Stimulators und der des Transducers.
Die Bedienung des Single-Sweep-Schalters ist identisch mit der des Zero-Adjust-Schalter des Transducers.
Der Clear-Screen-Schalter wird durch Maus-Klick gedrückt und nach dem Loslassen der Maus wieder gelöst.
Der Store-Schalter funktioniert ähnlich wie der Clear-Screen-Schalter. Im Unterschied zu letzterem wechselt er aber (falls das Oszilloskop angeschaltet ist) nach jedem Drücken vom aktivierten- in den inaktivierten Zustand und umgekehrt. Der aktivierte Zustand wird durch Aufleuchten des grünen Lichtes am Schalter angezeigt:

Abb. 4.1.8: Die vier Zustände des Store-Schalters: (1) gelöst und nicht aktiviert, (2) gedrückt und aktiviert, (3) gelöst und aktiviert, (4) gedrückt und nicht aktiviert. Falls das Oszilloskop ausgeschaltet ist hat der Schalter nur zwei Zustände: (1) und (4).
Bedienung der Dreh- und Schieberegler
Die Drehregler können auf zweierlei Weise betätigt werden: Durch Maus-Klick auf den gewünschten Endwert, und Drücken der Maustaste bis dieser erreicht ist. Außerdem durch Greifen des Reglers im Bereich des roten Zeigers und sukzessives Drehen des Reglers.
Die Schieberegler funktionieren ähnlich wie die des Stimulators nur in vertikaler Richtung. Sie befinden sich beide direkt links neben dem Oszilloskop-Bildschirm, um ihre Positionierung zu vereinfachen und sind übereinander beweglich. Der Regler für den ersten Kanal hat Priorität, falls sie übereinander liegen.
Diese Funktion gibt dem Anwender Informationen über die Urheber des Programms aus:

Abb. 4.1.9: Das Credits-Menu.
Das Credits-menu wird durch Betätigung des Beenden-Buttons verlassen.
Zum Verlassen des Programms dient der Quit-Button. Nach dessen Betätigung erscheint folgende Warnung:

Abb. 4.1.10: die Alert Box beim Verlassen des Programms.
Nach Drücken des Hilfe-Buttons erscheint das Hilfemenu, welches Information über die einzelnen Elemente des Programms ausgibt und ihre Bedienung erläutert:

Abb. 4.1.11: Das Hilfemenu. Der Anwender bekommt Informationen über die einzelnen Elemente des Programms und deren Bedienung. Fährt er mit dem Cursor (in Form einer zeigenden Hand) über ein Element, so wird dieses rot umrandet und die eintsprechende Information ausgegben.
Bedienung des Hilfe-Menus
Fährt der Anwender mit dem Maus-Cursor über ein Objekt, so wird dieses umrandet und der jeweilige Hilfe-Text im unteren Display angezeigt. Zum Beenden des Menus, wird der (untere) Return-Button gedrückt.
4.2 Konzeption von SimVessel
Mit dem Programm SimVessel kann der Benutzer die Einflüsse verschiedener Pharmaka und Vordehnungen auf die Kontraktionsverläufe glatter Muskeln experimentell erlernen.
4.2.1 Allgemeine Konzeption
Folgende Einzelversuche sind im Rahmen des Praktikums vorgesehen:
Tonische und phasische Kontraktionsformen
In diesem Versuchsteil lernt der Student die Mannigfaltigkeit glatter Muskulatur und ihre qualitativen Unterschiede kennen. Es steht ein phasisches Präparat der Eingeweide-Muskulatur (Antrum) und ein tonisches Präparat der Gefäßmuskulatur (Aorta) zur Verfügung.
Dosis-Wirkungs-Kurven aktivierender Transmitter
Glatte Muskulatur ist sympatisch und parasympatisch innerviert. Durch Ausschüttung der Neurotransmitter regeln die Nerven die Aktivität der Muskeln. Der wichtigste Neurotransmitter des parasympatischen Systems ist Acetylcholin, der wichtigste des sympatischen Systems ist Noradrenalin.
Myogene Aktivierung durch Vordehnung
Eine andere Art der Aktivierung myogener glatter Muskeln ist die Stimulierung durch Vordehnung. Dieser Effekt wird auch Bayliss-Effekt genannt. Er tritt sowohl bei Eingeweide- als auch bei Gefäßmuskulatur auf.
Funktioneller Antagonismus
Zwischen den Neurotransmittern des sympatischen und parasympatischen Systems besteht ein mehr oder weniger ausgeprägter Antagonismus.
Kompetitive Hemmung
Eine andere Art der Hemmung ist die spezifische Blockade von Rezeptoren. Der Student lernt die Wirkung von drei kompetitiven Rezeptorblockern: Atropin blockiert die muskarinischen ACh-Rezeptoren, Phentolamin die Alpha- und Propranolol die Beta1- und Beta2-Rezeptoren des adrenergen Systems.
Kalzium-Ionenkanal-Blockade
Eine unspezifische Art der Blockade, die auf alle glatte Muskeln wirkt, ist die Blockade der Kalzium-Ionen-Kanäle. Durch diese Blockade wird die intrazelluläre Kalzium-Konzentration und somit die Kontraktionsstärke vermindert.
Für die Simulation des in Kapitel 3.3 beschriebenen Glatte-Muskulatur-Versuches werden folgende (virtuellen) Elemente verwendet:
Um die unterschiedlichen Eigenschaften von Eingeweide-Muskulatur (Single-unit-Typ) und Muskulatur der größeren Blutgefäße (Multi-unit-Typ) zu demonstrieren, werden für den Versuch zwei Muskelpräparate zur Verfügung gestellt: Antrum als Beispiel des Single-unit-Typs und Aorta als Beispiel des Multi-unit-Typs.
Zur Aufrechterhaltung der Funktionalität der Präparate werden die Versuche im Organbad des Messgefäßes durchgeführt. Das Messgefäß kann jederzeit geleert und mit Krebslösung aus dem Vorratsgefäß gespült werden.
In der Realität werden die zu untersuchenden Wirksubstanzen mit einer Pipette in das Organbad appliziert. Da die Simulation dieses Vorganges auf dem Computer sehr aufwendig und zudem nicht anwenderfreundlich zu realisieren ist, werden die Substanzen mit Hilfe eines Perfusors appliziert.
Je nach Typ des glatten Muskels gibt es Rezeptoren für die verschiedensten Neurotrasmitter (z.B. ACh, NA, Serotonin), Gewebstoffe (z.B. Histamin, Prostaglandine) und Neuropeptiede. Für den Praktikumsversuch wurden die wichtigsten Neurotransmitter und einige Rezeptorblocker aus dieser Vielzahl ausgewählt.:
Acetylcholin aktiviert die Eingeweide-Muskulatur und wirkt als funktioneller Antagonist zu Noradrenalin.
Noradrenalin aktiviert die Gefäßmuskulatur und wirkt als funktioneller Antagonist zu Acetylcholin.
Verapamil wirkt als Blocker der Kalzium-Ionen-Kanäle und vermindert dadurch die Kontraktion beider Präparate.
Phentolamin wirkt kompetitiv hemmend auf Alpha-Rezeptoren.
Propranolol wirkt kompetitiv hemmend auf Beta-Rezeptoren.
Atropin blockiert die Acetylcholin-Rezeptoren und wirkt somit kompetitiv hemmend auf Acetylcholin.
Zur myogenen Erregung glatter Muskulatur durch Dehnung stehen dem Anwender zwei Gewichte zur Verfügung.
Die Verkürzung der Muskelpräparate wird mit Hilfe eines Transducers gemessen. Er gibt eine der Verkürzung des Muskels proportionale Spannung aus.
Diese Spannung wird mit Hilfe eines Papier-Schreibers aufgezeichnet. Auf diese Weise kann der Verlauf der Kontraktion über einen langen Zeitraum kontinuierlich aufgezeichnet werden. Mit Hilfe der Auswertefunktion werden alle aufgezeichneten Werte zugänglich gemacht.
Wegen der langsamen Kontraktionsverläufe glatter Muskulatur und den damit verbundenen langen Versuchszeiten wurde mit der Zeitraffer-Uhr die Möglichkeit geschaffen die Versuche schneller als in Wirklichkeit ablaufen zu lassen (reale Geschwindigkeit, doppelt und vierfach beschleunigt).
Am linken unteren Bildrand befindet sich die Menuleiste für die Navigations- und Informations-Buttons.

Abb. 4.2.1: Versuchsanordnung zur Simulation des Versuches zur glatten Muskulatur, bestehend aus: zwei glattmuskulären Präparaten (1), Organbad (2) mit Verratsgefäß (3), einem Transducer (4) zur Aufnahme der Längenänderung des Muskels, zwei Gewichten zu je 0,5g (5), Pipettiervorrichtung (6), einem Ständer für die Wirksubstanzen (7), der virtuellen Zeitraffer-Uhr zur Beschleunigung des Versuchsablaufes (8) und einem Papierschreiber (9). Zur Navigation und Information dienen die Buttons der Menuleiste (10).
4.2.2 Konzeption der Elemente
Um die Muskelpräparate vor Austrocknung zu schützen und ihre Funktionalität aufrecht zu erhalten, werden sie in Krebslösung aufbewahrt.

Abb. 4.2.2: Die zwei Muskelpräparate: Antrum als Beispiel des Single-unit-Typs der Eingeweidemuskulatur und Aorta als Beispiel des Multi-unit-Typs der Blutgefäßemuskulatur.
Das Ein- und Aushängen der Muskel
Mit gedrückter Maustaste können sie gegriffen und über den Bildschirm geschoben werden. Durch Berührung der Aufhängung im Organbad, werden sie in diese gehängt.
Durch erneutes Greifen werden sie wieder aus der Aufhängung genommen und in die Petrischale zurückgelegt.
In das Messgefäß wird jeweils einer der beiden Muskel gehängt. Die Flüssigkeit des Messgefäßes und des Vorratsgefäßes entspricht der physiologischen Extrazellulär-Flüssigkeit (Krebslösung) und wird mit einem Gemisch aus 95% Sauerstoff und 5% Kohlendioxid begast. In das Messgefäß werden mit dem Perfusor Substanzen appliziert, um deren pharmakologische Wirkung an den Muskeln zu messen. Zur Berechnung der Wirkstoffkonzentration ist das Gefäß immer mit einer definierten Flüssigkeitsmenge (30 ml) gefüllt.

Abb. 4.2.3: Messgefäß, Vorratsgefäß und Messwandler von SimVessel.
Durch Mausklick auf das unter dem Messgefäß befindliche Auslaß-Ventil wird der automatische Waschvorgang des Muskels und des Messgefäßes gestartet: Das untere Ventil öffnet sich und läßt die Flüssigkeit aus dem Gefäß fließen. Ist es vollständig geleert schließt es sich. Darauf öffnet sich das obere Ventil, so daß das Messgefäß wieder gefüllt wird. Ist die Flüssigkeitsmenge von 30 ml erreicht, schließt sich das obere Ventil wieder.
Der Muskel in dem Messgefäß ist über einen Faden mit dem Transducer verbunden. Dieser wandelt die Muskelbewegungen in elektrische Spannung um, welche auf dem Schreiber aufgezeichnet wird. Der Proportionalitäts-Faktor zwischen Längenänderung und Mess-Spannung beträgt 10mV/mm.
Durch Mausklick auf den Zero-Adjust-Knopf wird der Spannungsnullpunkt des Messwandlers mit der aktuellen Muskellänge verknüpft. Die Gewichte werden am Ende des Fadens, an dem das Muskelpräparat befestigt ist, angehängt.
Der Spannungsausgang des Transducers ist über ein BNC-Kabel mit dem Papierschreiber verbunden. Er dient zum kontinuierlichen Aufzeichnen der Mess-Spannung in den Programmen SimVessl und SimHeart.
Mit dem Power-Schalter wird er ein- und ausgeschaltet.
Die Einstellung der Geschwindigkeit und der Empfindlichkeit des Schreibers geschieht über zwei Drehregler (Speed und Resolution). Die aktuelle Einstellung dieser Regler wird automatisch auf das Papier geschrieben, ebenso wie andere Aktionen des Anwenders (-> Kapitel 5.3).
Mit Hilfe des am rechten Rand des Schreibers befindlichen Schiebereglers wird die Spannungsnullinie verändert, um die Kurve vertikal auf dem Papier zu positionieren.
Der rechts neben dem Resolution-Regler befindliche Erdungsschalter ermöglicht es diese Linie (z.B. nachdem sie verschoben wurde) aufzuzeichnen.
Um verschiedene Versuchsteile optisch voneinander zu trennen, hat der Anwender die Möglichkeit vier verschiedene Stiftfarben zu verwenden.
Die Information über das noch zur Verfügung stehende Papier wird in der Papier-Anzeige gegeben.

Abb. 4.2.4: Der Papierschreiber von SimVessel und SimHeart.
Bedienung der Schalter des Schreibers
Bei dem Power- und dem Erdungs-Schalter handelt es sich wie bei den Powerschaltern der Geräte in SimMuscle (-> Kapitel 4.1.2) um 2-State-Buttons.
Die Drehregler funktionieren genauso wie die des Oszilloskopes von SimMuscle (-> Kapitel 4.1.2).
Die Schalter zur Wahl der Stiftfarben sind miteinander verbunden. Das Drücken eines Schalters löst automatisch den zuletzt gedrückten.
In der Realität werden die Messkurven auf einen (entsprechend langen) Papierstreifen ausgegeben. Dieses ist bei einer Computersimulation natürlich nicht möglich, da die Bildschirmfläche begrenzt ist.
So mußte eine realitätsfernere, virtuelle Möglichkeit gefunden werden, dem Anwender alle Aufzeichnungen jederzeit zugänglich zu machen und die Auswertung parallel zur Durchführung des Versuches zu ermöglichen.
Zur Trennung der Auswertefunktionen von der realistischeren Simulation der Versuchsdurchführung, sind sie in dem (ausführlich in Kapitel 5.4 beschriebenen) Auswertefenster zusammengefaßt. Der Versuchsablauf bleibt auch während der Auswertung immer im Blickfeld.
In dem Reagenzglashalter stehen dem Anwender die für den Versuch benötigten Substanzen in verschiedenen Verdünnungen zur Verfügung. Die Substanz-Wahl geschieht über ein Standard-Macintosh-PopUpMenu.
Abb. 4.2.5: Der Reagenzglashalter von SimVessel und SimHeart. Die Auswahl der Wirkstoffe geschieht über ein Standard PopUpMenu des Macintosh-Betriebsystems.
Auswahl einer Substanz
Durch Mausklick auf das PopUpMenu wird dieses geöffnet (-> Abb. 4.2.5) und alle Verdünnungsreihen sichtbar. Mit gedrückter Maustaste, wird die gewünschte Substanz gewählt.
Dieses Gerät dient zum applizieren von Lösungen. Mit Hilfe des dreistelligen Zählwerkes wird die zu applizierende Flüssigkeitsmenge eingestellt. Der unterhalb des Zählwerkes befindliche Knopf appliziert die eingestellte Menge.

Abb. 4.2.6: Der Perfusor von SimVessel zum Applizieren von Wirksubstanzen. Die zu applizierende Reagenz wird in den Schacht gestellt, die gewünschte Menge gewählt und mit dem Freigabe-Knopf in das Organbad appliziert.
Applizieren einer Substanz
Das Reagenzglas der gewünschten Verdünnung der zu applizierenden Substanz wird mit der Maus gegriffen und mit gedrückter Maustaste über den Bildschirm bewegt. Bei Berührung des Perfusors, wird das Glas in dessen Ansaugschacht gestellt (-> Abb. 5.6.2). Nach Einstellung der gewünschten Flüssigkeits-Menge über das Zählwerk des Perfusors wird die Flüssigkeit durch den Auslöse-Knopf in das Organbad gegeben.
Zwei Gewichte zu je einem halben Gramm stehen zur Vordehnung der Muskel zur Verfügung.
![]()
Abb. 4.2.7: Mit Hilfe der zwei Gewichte werden die Muskeln gedehnt und so myogen erregt.
An- und Abhängen der GewichteDie Gewichte werden mit der Maus gegriffen und mit gedrückter Maustaste über den Bildschirm bewegt. Berühren sie den Haken am Seilende des Muskels, werden sie sukzessive an diesen gehängt.
Zum Abhängen der Gewichte werden sie gegriffen und vom Haken weg bewegt.
Sie zeigt die (programminterne) Versuchs-Zeit an. Durch Mausklick auf eines der drei Symbole kann der Anwender die Geschwindigkeit des Versuchsablaufes bestimmen: reale Geschwindigkeit, zweifach oder vierfach beschleunigt. Die programminterne Zeit läuft entsprechend schneller. Auf diese Weise kann die Versuchsdauer von z.B. vier Stunden auf eine Stunde reduziert werden.

Abb. 4.2.8: Die Zeitraffer-Uhr von SimVessel bestimmt die Geschwindigkeit mit der der Versuch abläuft: wie in der Realität, zweifach - oder vierfach beschleunigt. Das Symbol der gewählten Geschwindigkeit leuchtet auf. Im dargestellten Fall läuft der Versuch mit realistischer Geschwindigkeit ab.
4.3 Konzeption von SimHeart
Mit dem Programm SimHeart kann der Benutzer die Einflüsse verschiedener Pharmaka auf die Kontraktionskraft (Inotropie) und auf die Erregungsbildung der Automatiezentren (Chronotropie) des Herzens experimentell erlernen.
4.3.1 Allgemeine Konzeption
Folgende Einzelversuche sind im Rahmen des Praktikums vorgesehen:
catecholamine Wirkung am Herzen
Im Gegensatz zu vielen anderen vegetativen Organen, verfügt die Herzmuskulatur nur über Beta1-Rezeptoren. Da Adrenalin auf Beta1-Rezeptoren stärker wirkt als Noradrenalin, wird in diesem Versuchsteil erstere Substanz verwendet. In diesem Versuchsteil wird die inotrope und chronotrope Wirkung adrenerger Substanzen untersucht.
cholinerge Wirkung am Herzen
Ähnlich wie bei glatter Muskulatur, so existiert auch am Herzen ein funktioneller Antagonismus zwischen catecholaminer und cholinerger Wirkung. Acetylcholin bindet an die muskarinischen Rezeptoren des Herzens und wirkt negativ inotrop und negativ chronotrop.
Kompetitive Hemmung der ACh-Wirkung
Durch Atropin werden die muskarinischen ACh-Rezeptoren des Herzens - und somit die Wirkung von ACh blockiert.
Kompetitive Hemmung der Adr-Wirkung
Mit Hilfe des Beta-Blockers Propranolol, werden die Beta-Rezeporen am Herzen - und somit die Wirkung der Catecholamine blockiert.
Da das Herz keine Alpha-Rezeptoren hat, ist die Gabe eines Alpha-Blockers (z.B. Phentolamin) wirkungslos.
Kalzium-Ionenkanal-Blockade
Verapamil blockiert den Kalzium-Einstrom in die Herzmuskel-Zellen und wirkt auf diese Weise negativ inotrop.
Herzglykoside
Diese Pharmaka (z.B. Gamma-Strophantin) wirken positiv inotrop indem sie den Kalzium-Ausstrom aus der Zelle hemmen. Sie können allerdings leicht zu Arrythmien führen.
Zur Simulation des in Kapitel 3.6 dargestellten Langendorff'schen Herzmuskelversuches auf dem Computer, werden folgende virtuellen Elemente benötigt:
Die Perfusionsapparatur versorgt das Herz über die Aorta retrograd mit Nährlösung. Bei der Konzeption des simulierten Versuchsaufbaus wurde der flußkonstanten Variante der Vorrang gegenüber der druckkonstanten gegeben, da so die Dosierung der Pharmaka erleichtert wird. Außerdem kann auf diese Weise die Substratversorgung des Myokards besser eingestellt werden [8].
Auf Grund der (virtuellen) Flußkonstanz, konnte auf ein Flußmeter verzichtet werden. Statt dessen wird der konstante Fluß (10ml/min) am unteren Rand des Wärmetauschers per Notiz angezeigt.
Die Messung der Herzaktivität erfolgt gemäß den Empfehlungen von H. J. Döring und H. Dehnert mit Hilfe eines Ballonkatheters [8], der den vom linken Herzventrikel entwickelten isovoluminösen Druck mißt. Der mit dem Katheter verbundene Messwandler gibt die entsprechende elektrische Spannung aus.
Diese Ausgangsspannung wird verstärkt und mit Hilfe des Papierschreibers aufgezeichnet.
Der Perfusor kann bis zu zwei Wirksubstanzen gleichzeitig in den Nährlösungsstrom applizieren. Auf diese Weise ist es möglich sich gegenseitig beeinflussende Wirkungen zweier Substanzen zu untersuchen (z.B. bei kompetitiver Hemmung).
Dem Anwender werden folgende Medikamente in unterschiedlichen Verdünnungen zur Verfügung gestellt:
Acetylcholin ist der wichtigste Neurotransmitter der parasympatischen Nerven des Herzens. Es wirkt negativ inotrop und negativ chronotrop.
Adrenalin ist der wichtigste Neurotransmitter der sympatischen Nerven und wirkt positiv inotrop und positiv chronotrop.
Wie auch bei vielen glattmuskulären Muskeln sind Acetylcholin und Adrenalin funktionelle Antagonisten.
Phentolamin bindet an die adrenergen Alpha-Rezeptoren, welche (im Unterschied zur glatten Muskulatur) beim Herzen praktisch keine Rolle spielen.
Atropin bindet an die muscarinergen Alpha-Rezeptoren und wirkt so kompetitiv hemmend auf die Acetylcholin-Wirkung.
Der Beta-Blocker Propranolol bindet an die Beta1-Rezeptoren des Herzens. Die Adrenalin-Wirkung wird auf diese Weise kompetitiv gehemmt.
Verapamil ist ein Kalzium-Ionenkanal-Blocker und wirkt herzkraftsenkend. Es ist ein Beispiel der nicht-kompetitiven Hemmung.
gStrophantin, ein Herzglykosid, wirkt herzkraftsteigernd auf Grund der Hemmung der Natrium-Kalium-ATPase, welche den sekundären Kalzium-Auswärtstransport (durch Austausch von Kalzium gegen Natrium) antreibt. Herzglykoside können allerdings Arrythmien auslösen.
Wie in SimVessel, befinden sich am unteren linken Bildschrimrand die Navigations- und Information-Buttons.

Abb. 4.3.1: Versuchsanordnung der Simulation des Herzmuskel-Versuches nach Langendorff: Der Herzmuskel (1) wird mit Ringerlösung aus dem Vorratsgefäß (5) perfundiert. Sie wird mit 95% O2 und 5% CO2 begast (4) und im Wärmetauscher (2) temperiert. Der Thermostat (3) sorgt für gleichbleibende Temperatur. Die Kontraktion des Herzens wird mittels eines Ballonkatheters (6) gemessen. Die Spannung wird versärkt (7) und mit dem Schreiber (10) aufgezeichnet. Die Wirksubstanzen (9) können mit Hilfe eines Perfusors (8) appliziert werden. Die Navigations- und Informations-Buttons sind am unteren linken Bildrand platziert (11).
4.3.2 Konzeption der Elemente
Die Versuchsanordnung des Langendorff-Herzens wurde folgendermaßen realisiert:

Abb. 4.3.2: Die Perfusionsanordnung von SimHeart. Der hydrostatische Druck wird mit Hilfe der über dem Herzen befindlichen Wassersäule eingestellt. 80cm entsprechen einem Druck von etwa 60mmHg, welcher zur Perfusion von Meerschweinchenherzen empfohlen wird [8].
Der hydrostatische Druck der Wassersäule des Vorratsgefäßes sei so eingestellt, daß durch das Herz eine konstante Flüssigkeitsmenge von 10ml pro Minute fließt (-> Kapitel 3.1.3). Ebenso wie im Programm SimVessel entspricht die Flüssigkeit der Extrazellulärflüssigkeit und wird mit einem Gemisch aus 95% Sauerstoff und 5% Kohlendioxid begast. Mit Hilfe eines Wärmetauschers wird die Flüssigkeit auf Körpertemperatur gebracht. Die Temperatur an dem Thermostaten ist fest auf 37°C eingestellt.
Über einen kleinen Ballon, der sich in der linken Herzkammer befindet, wird die Kontraktionskraft des Muskels gemessen und mittels eines Messwandlers in elektrische Spannungen umgewandelt. Diese werden verstärkt und mit dem Papierschreiber aufgezeichnet.
Der in SimHeart verwendete Perfusor dient nicht zur einmaligen Gabe einer Substanzmenge, wie in SimVessel, sondern zur kontinuierlichen Perfusion des Herzmuskels mit bis zu zwei Substanzen gleichzeitig.
Abb. 4.3.3: Der Perfusor in SimHeart zur Perfusion des Muskels mit bis zu zwei Substanzen gleichzeitig.
Funktionsweise des Perfusors (-> Abb. 4.3.4)
1) Zunächst wird ein Reagenzglas in einen der beiden Schächte gestellt. Die Abkürzung des Substanznamens erscheint darauf in einem kleinen Fenster oberhalb des Reagenzglases.
2) Nach der Einstellung der Flußrate auf dem Zählwerk leuchtet ein rotes Lämpchen auf, was signalisiert, daß die aktuelle Flußrate, welche auf dem Startknopf angezeigt wird, aktualisiert werden sollte.
3) Der Update-Knopf überträgt den auf dem Zählwerk eingestellten Wert in das Register der aktuellen Flußrate des Startknopfes.
4) Durch Betätigung des Startknopfes wird die Perfusion mit der auf dem Knopf angezeigten Flußrate gestartet.
5) Der Startknopf bleibt solange gedrückt, bis die Perfusion durch den Stop-Knopf beendet wird.

Abb. 4.3.4: Funktionsweise des Perfusors in SimHeart.
Der Papierschreiber, die Navigations- und Informations-Buttons, der Auswerte-Bildschirm und der Reagenzglashalter von SimHeart sind identisch mit denen in SimVessel.
5 Realisierung der Programme
5.1 Echtzeitprogrammierung
Wichtig für die Realitätsnähe der Programme ist das Echtzeitverhalten des Algorithmus. Die größte Schwierigkeit dabei ist die permanente Berechnung und Ausgabe der Algorithmuswerte und sporadisch auftretenden Benutzeraktionen gleichzeitig ablaufen zu lassen. So sollte der Papierschreiber und die Luftblasenanimation bei SimVessel und SimHeart gleichmäßig weiter laufen, auch wenn der Anwender zur selben Zeit ein Reagenzglas über den Bildschirm bewegt, daß Messgefäß spült oder einen Schalter bedient. Da das Macintosh Betriebsystem zur Zeit noch nicht multitaskingfähig ist, müssen die Programme diese Aufgabe erledigen.
Den Kern der Programme SimVessel und SimHeart bildet eine Schleife, die immer in annähernd der selben Zeit durchlaufen wird, um die hohe Gleichmäßigkeit der Animationen zu ereichen:
long gRefTime = 5; // Schleifendurchlaufzeit 5 Ticks = 83 ms
long timeA; // Anfangszeit bei jedem Schleifendurchlauf
main(){
//-----------------------//
// Initialisierungs-Block //
//-----------------------//
while( TRUE ){ // EndlosSchleife
timeA=TickCount(); // Anfangszeit bestimmen
//-----------------//
// Funktions-Block //
//-----------------//
if( TickCount() - timeA > gRefTime )
gRefTime++; // ReferenzZeit überschritten -> ReferenzZeit erhöhen
else
while( TickCount() - timeA < gRefTime ); // ReferenzZeit unterschritten -> warten
} }
Am Anfang und am Schluß der Schleife wird die Zeit gemessen und solange gewartet, bis die Sollzeit erreicht ist (-> Abb. 5.1.1). Die Variable gRefTime bestimmt die Durchlaufzeit der Schleife in Ticks. Diese Referenzzeit sollte immer größer als die Gesamtlaufzeit aller während eines Schleifendurchlaufes abzuarbeitenden Funktionen sein.
Wird die Referenzzeit überschritten, so kann in der Testphase des Programms die Variable gRefTime automatisch um jeweils eine Einheit (16,66ms) erhöht werden. Auf diese Weise kann die minimale Schleifendurchlaufzeit auf den verschiedenen Rechnern ermittelt werden.
Da pro Schleifendurchlauf für jede der aufgerufenen Animationen jeweils ein Bild auf den Bildschirm gezeichnet wird, sollte diese Zeit möglichst klein sein, damit die Animationen den Eindruck einer gleichmäßigen Bewegung vermitteln.
Die von der Echtzeitschleife aufgerufenen Funktionen lassen sich in fünf Kategorien einteilen:
1.) Funktionen, die bei jedem Schleifendurchlauf ausgeführt werden. Die wichtigsten sind:
SelectCursor(); // Erkennung eines Objektes und Cursoränderung
StoreValues(); // Speicherung der Meßwerte
Plotter(); // Animation des Schreibers
Watch(); // Animation der Uhr
A_Blasen(); // Animation der Blasen
Muscle(); // Animation des Muskels in SimHeart
D_Muscle_Weight(); // Animation des Muskels in SimVessel
2.) Kurze Animationen, die durch den Anwender ausgelöst werden und innerhalb eines Schleifendurchgangs ausgeführt werden:
E_Button(); // Bedienung der Schalter
H_Counter(); // Bedienung des Zählwerks
3.) Vom Anwender gesteuerte Bewegungs-Animationen, die in mehreren Schleifendurchgängen schrittweise abgearbeitet werden:
B_MoveControl(); // Bewegung eines Objektes
Search(); // Bedienung des Suchfensters
CutReglerMove(); // Bedienung der Schieberegler des Suchfensters
MoveLasche(); // Animation der bewegten Karteilasche
KlebePfeil(); // Animation der auf die Kartei zu klebenden Pfeile
DrehRegler(); // Bedienung der Drehregler
4.) Vom Anwender ausgelöste und danach parallel ablaufende Animationen, die in mehreren Schleifendurchgängen abgearbeitet werden:
WaschMessBecher(); // Animation des Spülens des Messbechers in SimVessel
Movie(); // Animationen, die durch einen Movie dargestellt werden.
KarteiBeschriftung(); // Beschriftung der ausgewählten Ksrtei
5.) Systemroutinen, die nicht multitaskingfähig sind:
HandlePopUpMenu(); // Handling des PopUpMenus
Alert(); // Ausgabe einer Warnung
Die Addition der Laufzeiten der verschiedenen Funktionen läßt sich durch folgende vereinfachte Skizze darstellen:

Abb. 5.1.1: Addition der Laufzeiten verschiedener Funktionen und Wartezeitpufferung der Echtzeitschleife.
Um die Referenzzeit möglichst gering zu halten, muß die Gesamtlaufzeit aller während eines Schleifendurchlaufes abzuarbeitenden Funktionen möglichst klein sein. Die Referenzzeit der Schleife wurde folgendermaßen minimiert:
Bei der Reduzierung der Ausführungszeiten der einzelnen Funktionen wurde besonderes Augenmerk auf die Funktionen der ersten Kategorie gelegt, weil sie bei jedem Schleifendurchlauf ausgeführt werden.
Die Animationen der vierten Kategorie wurden ebenfalls zeitoptimiert, so daß sie parallel zu den anderen Funktionen ausgeführt werden können.
Von allen Funktionen der zweiten und dritten Kategorie muß immer nur eine während eines Durchlaufes ausgeführt werden, da sie direkt an die Benutzeraktion gebunden sind (man kann nicht gleichzeitig ein Objekt bewegen und einen Schalter drücken). So mußten besonders die zeitkritischsten Funktionen dieser Kategorien optimiert werden (B_MoveControl und Search).
Die Animationen des Schreibers und des Suchfensters sind besonders zeitaufwendig, da große Bildschirmbereiche verschoben werden müssen. Die Aufteilung der Programme SimVessel und SimHeart in einen Labor- und einen Auswertebildschirm trennt die beiden Animationen und vermindert so die Rechenzeit erheblich.
Die Animationen, die permanent ablaufen (Blasen-, Muskel- und Schreiberanimation), sind besonders wichtig für den realistischen Eindruck der Programme. Sie sollten möglichst am Anfang der Schleife stehen um den gleichmäßige Eindruck dieser Animationen zu erhöhen (-> Abb. 5.1.1).
Um die Ausführungszeiten der Funktionen zu senken, wird alles, was beim Start des Programms erledigt werden kann, in den Initialisierungs-Block (s.o.) verlagert. So werden alle verwendeten Bilder beim Start des Programms in den Speicher (OffScreen) geladen.
Alle Bildoperationen werden von Offscreens in den Bildschirmspeicher durchgeführt. Dieses ist zwar relativ speicherintensiv, doch ist das Kopieren von Bildern aus einem OffScreen in den Bildschirmspeicher ca. 40 mal (!!) schneller, als das direkte Kopieren von Bildern aus der Resource-Datei in den Bildschirmspeicher.
Durch diese und andere laufzeitsparenden Maßnahmen konnte die Referenzzeit auch bei langsamen Rechnern (z.B. LC475) auf fünf Ticks (=83ms) reduziert werden, so daß die Animationen mit 12 Bildern pro Sekunde laufen. Dieses kommt dem Auflösungsvermögen des menschlichen Auges von ca. 20 Bildern pro Sekunde ausreichend nah.
Bei SimMuscle wird das Echtzeitverhalten durch einen modalen Versuchsablauf erreicht. Im ersten Modus wird der Muskel in die Versuchsapparatur gehängt und die Geräte eingestellt. Nach Betätigung des Stimulus-Knopfes werden die Kurven berechnet, auf dem Oszi ausgegeben und der Muskel entsprechend animiert.
In diesem Modus kann der Anwender nur das Abbrechen der Reizsequenz durch einen Reset am Reizgerät ausführen. Da zur Zeit der Stimulation die Konzentration des Anwenders auf die Ausgabe der Werte gerichtet sein sollte, ist ein paralleler Versuchsablauf in diesem Fall nicht notwendig und so wurde aus Geschwindigkeitsgründen bei SimMuscle auf Multitaskingfähigkeit verzichtet.
5.2 Der Papierschreiber
Die Messwerte in den Programmen SimVessel und SimHeart sollen mit einem virtuellen Papierschreiber aufgezeichnet werden. Dieses Objekt sollte so programmiert sein, daß mit einer entsprechenden Anpassung beliebige Kurven mit ihm erfaßt werden können.
Wie bei einem realen Papierschreiber sind die Geschwindigkeit des Papiertransportes und die Auflösung des virtuellen Schreibers variabel. Sie werden mittels zweier Drehregler eingestellt. Die Auflösung des Schreibers wird in mV/div, die Geschwindigkeit in cm/min (SimVessel) bzw. cm/s (SimHeart), angegeben. Um Zeit- bzw. Spannungswerte auf dem Schreiberpapier ablesen zu können, befinden sich auf dem Papier vertikale und horizontale Hilfslinien.
Das Papier läuft von rechts nach links, damit die Zeitachse der dargestellten Kurve ("x-Achse") wie gewohnt nach rechts zeigt. Im Unterschied zu realem Papier besteht das virtuelle Papier aus diskreten Einheiten (Pixelspalten). Bei langsamen Geschwindigkeiten wird das Papier nach mehreren Schleifendurchläufen um einen Pixel verschoben. Bei schnellen Geschwindigkeiten wird es um einen bzw. mehrere Pixel pro Schleifendurchlauf verschoben. Darauf wird das Papier in dem freigewordenen Bereich nachgezeichnet (incl. Hilfslinien und Nummerierung) und schließlich die neuen Kurvenwerte auf das Papier gemalt:

Abb. 5.2.1: Verschiebung des Schreiberpapiers: 1.) Ausgangszustand, 2.) Verschiebung des Papiers, 3.) Nachzeichnen des Papiers, 4.) Nachzeichnen der Kurve.
Bei ersten Vorversuchen stellte sich heraus, daß zur Erfassung beliebiger Kurven mit dem Papierschreiber zwei wichtige Punkte zu beachten sind:
Die Abtastfrequenz des Schreibers muß groß genug sein um die Kurve hinreichend genau zu erfassen.
Außerdem sollte sie immer konstant sein unabhängig von der Schreibergeschwindigkeit, damit bei langsamen Geschwindigkeiten keine störenden Abtasteffekte auftreten.
Nach dem Abtasttheorem von Nykwist muß der Quotient aus der Abtastfrequenz und der zu messenden Frequenz deutlich größer als zwei sein:
Q = Fi/Fmess >> 2

Abb 5.2.2: Abtasttheorem von Nyquist: Der Quotiont (Q) aus der Abtastfrequenz und der maximalen zu messenden Frequenz muß deutlich größer als zwei sein. Im oberen Beispiel ist dieses nicht der Fall - die digitalisierte Kurve hat eine erheblich kleinere Frequenz, als die zu messende. Im unteren Beispiel wird die Frequenz der Messung richtig wiedergegeben. Um die Kurvenform hinreichend genau wiederzugeben wird allerdings eine viel höhere Abtastrate benötigt.
Die in den Programmen SimVessel und SimHeart verwendeten Schreiber arbeiten mit viel höheren Abtastfrequenzen, als es das Abtasttheorem von Nyquist vorschreibt:
Die maximale Schlagfrequenz des Herzmuskels einer Ratte liegt bei ca. fünf Schlägen pro Sekunde. In dem Programm SimHeart arbeitet der Schreiber mit einer Abtastfrequenz von 480/s (Q=96).
Die Spontanaktivität des Antrumpräparates liegt bei maximal vier Kontraktionen pro Minute. Der Schreiber im Programm SimVessel arbeitet mit einer Abtastfrequenz von 48/s (Q=720).
Die hohen Abtastfrequenzen führen zu einer hinreichend genauen Erfassung der Kurvenformen.
Bevor die berechneten Algorithmuswerte auf dem Schreiber ausgegeben werden, müssen sie zunächst aufbereitet werden:
Ein realer Schreiber mit schubweisem Papiertransport zeichnet die Messwerte, die in der Zeit zwischen zwei Schüben auftreten, als Strich senkrecht zur Transportrichtung auf das Papier.
Der virtuelle Schreiber funktioniert analog. Ist die aktuelle Geschwindigkeit des virtuellen Schreiber, um einen Faktor k kleiner als die Abtastrate, wird aus k Messwerten das Minimun und das Maximum berechnet und als vertikaler Strich auf das Papier geschrieben.
Damit dabei eine durchgehende Kurve entsteht muß gewährleistet sein, daß sich zwei benachbarte Balken berühren. D.h. das Maximum eines Balkens sollte nicht kleiner als die Minima der benachbarten Balken und das Minimum eines Balkens sollte nicht größer als die Maxima der benachbarten Balken sein. Dieses kann dadurch gewährleistet werden, daß als Startwert bei der Maximum-Berechnung der aktuellen Pixelspalte das Minimum der zuletzt berechneten Pixelspalte genommen - und als Startwert bei der Minimum-Berechnung das Maximum der zuletzt berechneten Pixelspalte genommen wird.
Damit die Werte noch zur Auswertung zur Verfügung stehen, werden sie gleichzeitig gespeichert ( jeweils Minimum und Maximum ).
Um den Schreiber an unterschiedliche Einsatzgebiete anzupassen, können einige Konstanten verändert werden. Die wichtigsten Konstanten des Schreibers von SimVessel stehen in der Headerdatei Labor-Vessel.h:
#define TIME_SCALE_INTERVALL 18 // virtueller cm in Pixeln
#define GEAR_VECTOR {0,-160,-80,-40,-20,-8,-4,-2,0,0 } // Geschwindigkeiten
#define SCAN_RATE 4 // entspricht 48/s
#define MAX_STORE_NR 170000L // Anzahl der gesamzten Pixelspalten
Die Konstanten von SimHeart befinden sich in der Datei Labor-Heart.h:
#define TIME_SCALE_INTERVALL 24 // virtueller cm in Pixeln
#define GEAR_VECTOR {0,-10,-5,-2, 1, 2, 4, 10, 0, 0 } // Geschwindigkeiten
#define SCAN_RATE 40 // entspricht 480/s
#define MAX_STORE_NR 170000L // Anzahl der gesamzten Pixelspalten
Die Konstante TIME_SCALE_INTERVALL definiert die Breite eines virtuellen Zentimeters (der Abstand zweier horizontaler Hilfslinien auf dem Papier) in Pixeln.
Die Geschwindigkeiten werden über die Konstante GEAR_VECTOR festgelegt. Entsprechend der Anzahl der Drehregler-Schalterstellungen handelt sich um einen Vektor mit zehn Elementen. Jedes Element ist mit einer Schalterstellung des Geschwindigkeits-Drehreglers verknüpft. Der Eintrag einer Null in den Vektor entspricht der Geschwindigkeit Null. Hohe Geschwindigkeiten werden durch einen positiven Wert festgelegt. Der Wert definiert die Verschiebung des Papiers pro Schleifendurchlauf in Pixeln. Niedrige Geschwindigkeiten haben einen negativen Eintrag. Dieser bestimmt die Anzahl der Schleifendurchläufe, die gewartet wird, bis das Papier um einen Pixel verschoben wird. Mit der festen Schleifendurchlaufzeit von 83ms ergeben sich in den Programmen SimVessel und SimHeart folgende Geschwindigkeiten:
Tab. 5.1: Geschwindigkeiten und Abtastraten des in SimVessel verwendeten Schreibers. Die erste Zeile gibt an wieviel Pixel des Papiers pro Schleifendurchlauf verschoben werden. Mit der Definition eines virtuellen Zentimeters durch die Skaleneinteilung des Papiers, die in der dritten Zeile angegeben ist, ergeben sich die Geschwindigkeiten des Schreibers in cm/min. Die Abtastrate in 1/s ergibt sich aus der Abtastrate pro Schleifendurchlauf durch Division mit der Schleifendurchlaufzeit (83ms).
|
Pixel/Durchlauf |
1/160 |
1/80 |
1/40 |
1/20 |
1/8 |
1/4 |
1/2 |
||||||
|
Speed [cm/min] |
0,25 |
0,5 |
1 |
2 |
5 |
10 |
20 |
||||||
|
Pixel/cm |
18 |
||||||||||||
|
Abtastrate [1/s] |
48 |
||||||||||||
Tab. 5.2: Geschwindigkeiten und Abtastraten des in SimHeart verwendeten Schreibers.
|
Pixel/Durchlauf |
1/10 |
1/5 |
1/2 |
1 |
2 |
4 |
10 |
||||||
|
Speed [cm/s] |
0,05 |
0,10 |
0,25 |
0,5 |
1 |
2 |
5 |
||||||
|
Pixel/cm |
24 |
||||||||||||
|
Abtastrate [1/s] |
480 |
||||||||||||
Die Konstante MAX_STORE_NR legt die Anzahl der zur Verfügung stehenden Pixelspalten fest. Dieser Wert ist durch den Speicher, der dem Programm zugeteilt wird begrenzt. Bei einer Erhöhung dieses Wertes muß evtl. auch der dem Programm zugeteilte Speicher vergrößert werden.
Die Farben des Papiers, der Hilfslinien und der vier Stifte sind in den Resourcedateien labor-Vessel.preferences bzw. labor-Heart.preferences definiert und können durch Doppelklick auf diese Dateien geändert werden, falls das Programm ResEdit auf dem Rechner vorhanden ist. Bei den Farbwerten handelt es sich um indizierte Farben der Standardpalette. Im Anhang ist die gesamte Palette dieser 256 Farben abgedruckt. Standardmäßig sind folgende Farbwerte eingestellt:
Tab. 5.3: Standardeinstellung der Papierfarbe, der Farbe der Papier-Hilfslinien und der Stiftfarben. Bei den Farbwerten handelt es sich um indizierte Farben der Standardpalette.
|
ID |
Bezeichnung |
Farbwert |
|
0 |
Papierfarbe |
80 |
|
1 |
Papierbeschriftung |
86 |
|
10 |
Stiftfarbe 1 |
199 |
|
11 |
Stiftfarbe 2 |
220 |
|
12 |
Stiftfarbe 3 |
34 |
|
13 |
Stiftfarbe 4 |
2 |
5.3 Automatische Protokollführung
Bei einer Papierschreiberaufzeichnung ist es wichtig, einige Parameter, die während des Versuchsablaufs geändert wurden, auf dem Papier festzuhalten. Dem Anwender die Möglichkeit zu geben dieses selbst durchzuführen, stellte sich als äußerst schwer zu realisierende Aufgabe dar, da viele Funktionen des Macintosh-Betriebsystems nicht multitaskingfähig sind und die Entwicklung analoger multitaskingfähiger Funktionen sehr aufwendig ist. Außerdem hätten sich zwangsläufig Platzprobleme auf dem Bildschirm ergeben. Eine solche Beschriftungs-Funktion wäre zudem realitätsfern und würde den Versuchsablauf stören, da es die Aufmerksamkeit des Anwenders vom Versuch abzieht. Auch würde es sicherlich zu Bedienungsproblemen und damit schnell zur Frustration führen.
Eine automatische Protokollführung gewährleistet den sicheren Ablauf des Versuches und gibt dem Anwender die Möglichkeit, sich ganz auf den Versuch und die Lerninhalte zu konzentrieren.
In den Programmen SimVessel und SimHeart werden folgende Informationen automatisch auf dem Schreiberpapier protokolliert:
SimHeart
das Hinzufügen von Lösungen (z.B. "-5,ACh,10
die eingestellte Auflösung des Schreibers (z.B. "20mV/div")
die eingestellte Schreibergeschwindigkeit (z.B. "2cm/s")
SimVessel
der ins Messgefäß eingehängte Muskel (z.B. "Antrum")
das Betätigen des Zero-Adjust-Knopfes ("Zero-Adjust")
das Betätigen der Spülvorrichtung ("Gewaschen")
das Hinzufügen von Lösungen (z.B. "-5/ACh/10
die eingestellte Auflösung des Schreibers (z.B. "20mV/div")
die eingestellte Schreibergeschwindigkeit (z.B. "2cm/min")
Das Protokollieren erfolgt zeitgleich mit der jeweiligen Aktion. Der Zeitpunkt wird auf dem Papier durch einen vertikalen Strich angezeigt. Auf diese Weise läßt sich der Versuchsablauf bei der späteren Bearbeitung im Auswertefenster (-> Kapitel 5.4) wieder nachvollziehen.

Abb. 5.3.1: Automatisches Protokollieren der Versuchsparameter am Beispiel von SimVessel.
Um die Kurve möglichst wenig zu überschreiben, werden die Notizen auf den oberen und unteren Randbereich des Papiers gedruckt (-> Abb. 5.3.1):
Am unteren Rand des Papiers wird die Geschwindigkeit und die Auflösung des Schreibers notiert. Diese Informationen geben dem Anwender die Möglichkeit eine horizontale bzw. vertikale Strecke auf dem Papier in das entsprechende Zeit- bzw. Spannungsäquivalent umzurechnen. Bei der Betätigung eines Schreiberdrehreglers (Speed oder Resolution) werden immer beide Informationen in einem Block zusammengefaßt auf das Papier geschrieben, um dem Anwender unnötiges Suchen zu ersparen und so die Versuchsauswertung zu erleichtern.
Im oberen Bereich des Papiers werden die Benutzeraktionen festgehalten, die sich nicht auf den Papierschreiber beziehen. Die einzelnen Notizen sollten so kurz wie möglich sein und dennoch alle wichtigen Informationen enthalten. Das Applizieren von
Für die Speicherung der Notizen stehen zwei Vektoren zur Verfügung. Jedem Byte dieser Vektoren ist eine Pixelspalte des Papiers zugeordnet. Die Information über die Geschwindigkeit und die Auflösung des Schreibers wird in einem der Vektoren gespeichert. Bevor eine Notiz auf das Papier geschrieben wird, wird die entsprechende Information in dem Byte, daß der äußerst rechten Pixelspalte des Schreibers zugeordnet ist, gespeichert. Dieses ist möglich, da die beiden Drehregler, die die Geschwindigkeit und die Auflösung des Plotters bestimmen, maximal zehn Schalterstellungen haben. In einem Byte kann ein Zahlenwert von 0 bis 255 gespeichert werden. Teilt man ein Byte in 2*4 Bit, so kann in den beiden Hälften jeweils ein Zahlenwert von 0 bis 15 gespeichert werden.
Der zweite Vektor dient der Speicherung der Notizen, die sich nicht auf den Papierschreiber beziehen. Hier können die Informationen nicht direkt in einem Byte gespeichert werden, da es schon bei der Beschreibung der hinzugefügten Lösung theoretisch 23976 Kombinationsmöglichkeiten gibt. Die generierten Notizen werden als Text in einem Text-Vektor mit 256 Elementen gespeichert. In dem Zahlenvektor wird dann nur noch die entsprechende Text-Nummer als Byte eingetragen. Es verknüpft so einen beliebigen Text mit einer Pixelspalte auf dem Papier.
Diese Art der Speicherung ist zwar sehr speicherintensiv, aber dafür sehr schnell und gewährleistet auch im (zeitkritischeren) Auswertebildschirm das Echtzeitverhalten der Programme.
5.4 Der Auswertebildschirm

Abb. 5.4.1: Ausschnitt des Auswertefensters von SimVessel und SimHeart. Links oben ist der Papierschreiber mit den aktuellen Messwerten zu sehen. Rechts oben befindet sich das Suchfenster und darunter die Kartei (verkleinern!!).
Bei der Durchführung eines Versuchs ist es wichtig die Messergebnisse gleichzeitig auszuwerten, um eventuelle Fehlerquellen frühzeitig auszuschalten und um sicher zu gehen, daß alle wichtigen Parameter erfaßt wurden. Die mit dem virtuellen Schreiber der Programme SimVessel und SimHeart aufgezeichneten Kurven und die protokollierten Aktionen, sollten deshalb dem Anwender während der Durchführung und der Auswertung des Versuchs jederzeit zugänglich sein. Bei der Auswertung der Messkurven sollten die aktuellen Messkurven dabei immer im Blickfeld bleiben. Außerdem muß die Möglichkeit gegeben sein die Kurven zu markieren, zu kommentieren und ausgewählte Kurvenstücke auf einem Drucker auszugeben.
In den Programmen SimVessel und SimHeart geschieht die Auswertung in einem eigenen, von der Versuchsdurchführung getrennten Bildschirm - dem Auswertebildschirm. Die modale Aufteilung in einen Laborbildschirm und einen Auswertebildschirm hat folgende Vorteile:
Eine Realisierung der Auswertefunktion innerhalb der Laborumgebung hätte zwangsläufig Platzprobleme auf dem Bildschirm ergeben. Dieses hätte wiederum eine Einschränkung des Bedienungskomforts und der Übersichtlichkeit mit sich gebracht.
Um das Echtzeitverhalten der Programme zu gewährleisten, können die Animationen des Laborbildschirms nicht gleichzeitig mit dem viel Rechenzeit benötigenden Suchfenster dargestellt werden.
Die Aufteilung in zwei Bildschirme trennt den virtuelleren Auswerteteil von dem Laborteil. Dieses erhöht die Realitätsnähe im Laborbildschirm.
Die Überblendfunktion beim Wechsel zwischen den beiden Bildschirmen verbindet die beiden Teile miteinander indem die Bildschirme als Teile einer zusammenhängenden Arbeitsfläche gezeigt werden.
Der modale Aufbau trennt die Erfassung der Messwerte von der Auswertung und fördert so die Konzentration des Anwenders auf die jeweilige Tätigkeit.
Das Suchfenster
Bei einem realen Papierschreiber wird die Messkurve auf das Papier gezeichnet und ist so in ihrer Gesamtheit jederzeit sichtbar.
Da die Fläche auf dem Computerbildschirm jedoch begrenzt ist, wurde das Suchfenster entwickelt, mit dem sich der Anwender Ausschnitte der Kurve anschauen kann.
Durch Greifen und Verschieben des Ausschnittes können alle Bereiche der Messkurve sichtbar gemacht werden.
Dem Anwender wird über eine Schalterleiste am linken Rand des Suchfensters die Möglichkeit gegeben, die Geschwindigkeit der Verschiebevorrichtung zu verändern. Es stehen drei Geschwindigkeiten zur Verfügung (1, 10 und 100 Pixel Papierverschiebung bei Bewegung des Maus-Cursors um einen Pixel).
Speicherung des beschriebenen Papiers
Aus Speichergründen ist es ungünstig das mit der Kurve und Texten beschriebene Papier als Bild abzuspeichern. Bei einer Papierbreite von 200 Pixeln würde das Speichern einer Pixelspalte 200 Byte benötigen. Durch Speicherung der relevanten Parameter und Nachzeichnen des Papiers werden nur fünf Byte pro Pixelspalte gebraucht.
Der Versuchsablauf bleibt immer im Blickfeld
Bei der Versuchsauswertung ist es wichtig die aktuelle Messkurve immer im Blick zu behalten, um den Ablauf des Versuchs zu kontrollieren und den aktuellen Kurvenausschnitt mit anderen Ausschnitten der Kurve vergleichen zu können.
Aus diesem Grunde ist im Auswertefenster der rechte Teil des Papierschreibers mit den aktuellen Kurvenaufzeichnungen zu sehen.
Durch die Positionierung des Suchfensters direkt neben dem Schreiber wird der Vergleich von Kurvenausschnitten erleichtert. Zur horizontalen Verschiebung der aktuellen Kurvenaufzeichnungen kann der Schieberegler am rechten Rand des Schreibers benutzt werden.
Zur Erleichterung der Auswertung und zum Drucken von Kurvenzügen, können Kurvenausschnitte aus dem Suchfenster in Karteifächer kopiert werden. Der zu kopierende Kurvenausschnitt wird dabei durch zwei Schieberegler am unteren Rand des Suchfensters festgelegt. Durch drücken der Kopierfunktion der Karteimenuleiste wird der Ausschnitt in das aktuelle Karteifach kopiert.
Ist das Karteifach bereits belegt, erfolgt eine Warnung.
Es stehen 15 Karteifächer zur Verfügung, die jeweils eine Lasche am linken Rand der Kartei haben. Die Wahl des aktuellen Karteifaches geschieht entweder durch Anklicken der entsprechenden Lasche, oder mit Hilfe zweier Tasten der Karteimenuleiste. Es wird durch eine dickere Umrandung hervorgehoben.
Ist das Karteifach mit einem Kurvenausschnitt belegt, so wird die Lasche in der Papierfarbe gezeichnet.
Um den Inhalt eines Karteifaches in ein anderes Fach zu verschieben, wird eine Lasche angeklickt und mit gedrückter Maus über die Lasche eines anderen Faches gezogen. Die ausgewählten Zielfächer werden während der Verschiebung durch kleine rote Pfeile angezeigt.
Das Löschen des Inhaltes einer Kartei geschieht mit Hilfe der Löschfunktion der Karteimenuleiste.
Bei der Auswertung ist es wichtig die Messergebnisse zu dokumentieren. Die Beschriftungsfunktion der Karteimenuleiste ermöglicht es die in den Karteifächern abgelegten Kurvenausschnitte zu beschriften.
Mit Hilfe von Informationspfeilen, die auf der Kurve plaziert werden, kann auf bestimmte Teile des Kurvenzuges hingewiesen und durch die Numerierung der Pfeile bei der Beschriftung darauf Bezug genommen werden.
Zur Archivierung der Messungen können mit Hilfe der Druckfunktion die in den Karteifächern abgelegten Kurvenzüge und die dazugehörigen Beschriftungen ausgedruckt werden.
Um den Überblick zu behalten welche Kurvenstücke in welchem Karteifach abgelegt sind, werden die in das Karteifach kopierten Kurvenzüge in dem Suchfenster durch horizontale Balken gekennzeichnet und diese mit der Nummer des Karteifaches beschriftet.
Diese Funktion des Karteimenus sucht den in das aktuelle Karteifach kopierten Papierausschnitt und zeigt ihn im Suchfenster an.
Dieses erspart das Suchen des Ausschnittes, wenn man sich ihn z.B. nochmals im Zusammenhang ansehen möchte. Außerdem wird so das Beschriften eines Ausschnittes erleichtert.
5.5 Die Muskelanimation in SimMuscle
Wichtig für einen realistischen Eindruck der drei Simulationsprogramme sind die Animationen der Muskeln. Da die Realisierungen der Muskelanimationen der Programme SimVessel und SimHeart auf der des Programms SimMuscle basiert, wird die Konzeption der Realisierung am Beispiel von SimMuscle beschrieben.
Bei der isotonischen Zuckung wird der Muskel mit einer konstanten Gewichtskraft belastet. Im Gegensatz zur isometrischen Zuckung, bei der der Muskel auf einer konstanten Länge gehalten wird, kann er sich bei der isotonischen Zuckung frei bewegen. Um eine solche Bewegung zu animieren, wird eine Sequenz von Bildern benötigt, die jeweils einem Stadium der Zuckung entsprechen. Bei der Zeichnung der Bilder muß berücksichtigt werden, daß der Muskel durch Belastung mit Gewichten vorgedehnt wird (-> Abb. 5.5.1, Bilder 0-4 ):

Abb. 5.5.1: Interne Numerierung der Muskelbilder von SimMuscle. Die Bilder 0-4 zeigen den vorgedehnten Muskel, Bild 5 den Ruhezustand des Muskels ohne Gewicht und Bilder 6-11 Kontraktionszustände des Muskels.
Die Bilder der Ruhezustände des Muskels in Abbhängigkeit von der Gewichtsbelastung sind in der Datei Muscle+Weights.c durch die Variable g_StartPict definiert:
Tab. 5.4: Die Bildnummer des ruhenden Muskels (g_StartPict ) in Abhängigkeit von der Anzahl der angehängten Gewichte.
|
short g_StartPict[ NR_WEIGHTS ] = { 5,4,3,2,1,0,0 }; |
|||||||||||||||||||||
|
Gewichte |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
||||||||||||||
|
Startbild |
5 |
4 |
3 |
2 |
1 |
0 |
0 |
||||||||||||||
Die Animation des Muskels geschieht dadurch, daß nach der Berechnung des Algorithmus und der Ausgabe des berechneten Wertes auf dem Osilloskop das entsprechende Muskelbild berechnet und auf den Bildschirm gezeichnet wird.
Abb. 5.5.2: Die Berechnung des zu zeichnenden Muskelbildes am Beispiel eines Muskels ohne Gewichtsbelastung. Die obere Kurve zeigt die maximale tetanische Reizung - die untere eine Einzelzuckung.
Die Berechnung des Muskelbildes geschieht in der Funktion Zuck(). Die Funktion DrawMusclePict_pro() zeichnet dann das entsprechende Bild (0-11) auf den Bildschirm:
zuck(){
double kontraktion; // 0 -> entspannt 1 -> maximal kontrahiert
long bild;
long startBild;
startBild = g_StartPict[ ReturnParameter(weights) ];
kontraktion = (double) f / (double) fmax;
bild = ( NR_MUS_PIC - 1 - startBild ) * kontraktion + startBild;
if( bild < startBild ) bild = startBild;
if( bild > NR_MUS_PIC-1 ) bild = NR_MUS_PIC-1;
DrawMusclePict_pro( (unsigned long) bild ); }
Wie bereits erwähnt, kann der Skelettmuskel in SimMuscle mit sechs Gewichten zu je 50g vorgedehnt werden. Es werden folgende Bilder für die Gewichtsanimation verwendet:

Abb. 5.5.3: Die Bilder der an den Muskel gehängten Gewichte. Das linke Bild wird gezeichnet, wenn der Muskel nicht mit einem Gewicht belastet ist.
Da die Gewichte mit dem Muskel verbunden sind und sich demzufolge synchron mit ihm bewegen, wäre es prizipiell möglich, den Muskel und die Gewichte durch einen Satz von 69 Bildern, die gleichzeitig Muskel und Gewichte zeigen, zu animieren. Aus folgenden Gründen wurde aber die Realisierung durch zwei gekoppelte Animationen bevorzugt:
Bei der Realisierung durch zwei gekoppelte Animation werden nur die 7 Gewichtsbilder und die 12 Muskelbilder benötigt.
Da Änderungen am Hintergrund der Animation in allen Bildern erfolgen müssen, ist auch aus diesem Grund die getrennte Lösung vorzuziehen.
Eine Trennung der Animationen hat zudem den Vorteil höherer Flexibilität, die gerade in der Planugs- und Realisierungsphase sehr wichtig ist. Eine spätere Erweiterung (z.B. der Anzahl der Muskelbilder um eine fließendere Bewegung zu erzeugen) ist nur durch die Realisierung in zwei Animationen ohne Schwierigkeiten möglich.
Durch einen Trick ist es bei der Trennung der Animationen möglich auf zusätzliche Bilder für die Animation der isometrischen Bewegung zu verzichten (s.u.).
Beim Einhängen eines Muskels oder eines Gewichts wird zunächst der entsprechende Ruhezustand des Muskels (-> Tab. 5.3) und darunter das Bild des Gewichts gezeichnet.
Bei isotonischen Messbedingungen kann der Muskel und somit auch das Gewicht eine vertikale Bewegung ausführen. Um die Position des Gewichtsbildes auf dem Bildschirm bestimmen zu können, muß die Verkürzung des Muskels quantitativ bekannt sein. Diese Information ist in der Variablen gPixelKontraktion enthalten:
Tab. 5.5: Verkürzung der Muskelbilder im Vergleich zum Bild des maximal vorgedehnten, ruhenden Muskels (Bild 0), angegeben in Pixeln.
|
short gPixelKontraktion [ NR_MUS_PIC ] = { 0,1,3,5,7,9,11,13,15,16,17,18 }; |
||||||||||||||||||||||||||||||||||||
|
Bild |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
||||||||||||||||||||||||
|
Kontrakt. |
0 |
1 |
3 |
5 |
7 |
9 |
11 |
13 |
15 |
16 |
17 |
18 |
||||||||||||||||||||||||
Um einen möglichst flackerfreien und fließenden Eindruck zu erzeugen, ist die Animation in mehrere Teilschritte unterteilt. Die Verkürzung des Muskels wird in drei Teilschritten durchgeführt (-> Abb. 5.5.4):
Zuerst wird das Bild des kürzeren Muskels an die Stelle des zuletzt gezeichneten Muskelbildes gezeichnet (2).
Danach wird das Gewicht um die entsprechende Distanz nach oben geschoben (3).
Zuletzt werden die Reste des zuletzt gezeichneten Gewichtsbildes mit dem Hintergrund übermalt (4).
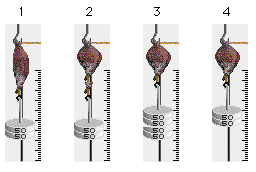
Abb 5.5.4: Muskel- und Gewichtsanimation bei der Kontraktion des Muskels: 1.) Ausgangszustand, 2.) Zeichnen des neuen Muskelbildes, 3.) Verschieben des Gewichts, 4.) Aktualisieren des Hintergrundes.
Die Entspannung des Muskels wird in zwei Teilschritten durchgeführt (-> Abb. 5.5.5):
Das Gewicht wird zunächst nach unten geschoben (2).
Darauf wird das aktuelle Muskelbild gezeichnet (3).

Abb 5.5.5: Muskel- und Gewichtsanimation bei der Dilatation des Muskels: 1.) Ausgangszustand, 2.) Zeichnen des Gewichtes an die neue Position, 3.) Zeichnen des neuen Muskelbildes.
Bei der isometrischen Zuckung wird der Muskel durch Arretierung der Versuchsapparatur auf der jeweiligen, durch die Vordehnung mittels der Gewichte bestimmten, Ruhelänge gehalten.
Für den ruhenden Muskel stehen, wie bei der isotonischen Kontraktion, sechs Startbilder unterschiedlicher Länge zur Verfügung (-> Tab. 5.3). Bei der isometrischen Kontraktion wäre eigentlich zu jedem Startbild ein Satz von Bildern nötig, um die isometrische Bewegung zu animieren. Durch einen einfachen Trick gelingt es aber auf zusätzliche Bilder zu verzichten:
Die Funktion CopyBits() des Macintosh-Betriebsystems ermöglicht nicht nur das Kopieren und Verschieben von Bildschirmbereichen und OffScreen-Grafiken, sondern auch deren Deskalierung. Versuche ergaben, daß die isometrische Bewegung sehr gut mit vertikal vergrößerten Kontraktionsbildern der isotonischen Bewegung animiert werden kann. Diese Bilder werden automatisch von dem Programm in der Funktion DrawMusclePict() erzeugt.

Abb. 5.5.6: Vertikale Vergrößerung der Kontraktionsbilder, die bei der Animation der isotonischen Bewegung verwendet werden, liefert die Kontraktionsbilder für die Animation der isometrischen Bewegung. Die Startbilder sind in beiden Fällen identisch.
Abgesehen von der Verwendung eines anderen Algorithmus, ist die Berechnung des zu zeichnenden Muskelbildes im Fall der isometrischen Bewegung analog zu der im Fall der isotonischen Bewegung. Dieses Bild wird, wie in Abbildung 5.5.6 gezeigt, deskaliert und auf dem Bildschirm ausgegeben. Die so berechneten Bilder sind im Anhang (-> Kapitel 9.2) dargestellt.
Eine Animation der Gewichte ist im Fall der isometrischen Bewegung nicht nötig.
5.6 Bewegliche Objekte
Ein wichtiger Bestandteil von interaktiven Computerprogrammen sind bewegliche Objekte.
Da in allen drei Simulationsprogrammen bewegliche Objekte vorkommen, wurde eine allgemeine Funktion zur Animation beweglicher Objekte entwickelt, die leicht an andere Versuchsumgebungen angepaßt werden kann.
In den Simulationsprogrammen kommen folgende bewegliche Objekte vor:

Abb 5.6.1: Bilder der beweglichen Objekte, die in den drei Simulationsprogrammen verwendet werden.
Beim Start des Programmes ermittelt die Funktion Z_LoadPict() die Konturen der Bilder und speichert diese in Form von Regionen ab, um die Bewegung beliebig geformter Objekte zu ermöglichen.
Die Bilder der beweglichen Objekte sind in den entsprechenden Projekt-Resource-Dateien gespeichert. Aus Konventionsgründen müssen sie auf weißem Hintergrund gezeichnet sein, damit die Funktion ihre Konturen richtig bestimmen kann! Außerdem sollte die Farbe Weiß beim Zeichnen der Objekte nicht verwendet werden, da das Objekt sonst an diesen Stellen durchscheinend ist. Anstelle der Farbe Weiß kann das hellste Grau verwendet werden (Farbwert 245 -> Abb. 9.1.1).
Mit Hilfe der Bewegungsanimation werden die Objekte an verschiedenen Orten auf dem Bildschirm positioniert. Dieses bedeutet, daß der Bildhintergrund durch die Animation verändert wird. Neben den Bildern der beweglichen Objekte müssen somit auch alle möglichen Änderungen des Bildhintergrundes an den Start und Endpunkten als Bilder vorliegen. Die Hintergundbilder dienen dazu einen Ausschnitt des Bildhintergrundes zu aktualisieren. So wird das Objekt nachdem es gegriffen wurde und als bewegliches Objekt zu sehen ist aus dem Bildhintergrund gelöscht und nach dem Ablegen an einem Ruhepunkt an der entsprechenden Stelle wieder in das Hintergrundbild gezeichnet. Jedes Hintergrundbild wird durch die Funktion DrawFixPict() an eine feste Position auf den Bildschirm gezeichnet. Die in den Programmen SimVessel, SimHeart und SimMuscle verwendeten Hintergrundblider sind im Anhang (-> Kapitel 9.4) dargestellt.
Der Ablauf der Bewegungsanimation erfolgt in fünf Schritten (-> Abb. 5.6.2):
1.) Befindet sich die Maus über einem beweglichen Objekt, wird dieses von der Funktion SeclectCursor() registriert. Der Cursor wird zu einer offenen Hand und zeigt dem Anwender an, daß er dieses Objekt greifen und bewegen kann.
2.) Durch Drücken der Maustaste wird das Objekt "gegriffen". Das Objekt wird aus dem Hintergrund gelöscht, indem das entsprechende Hintergrundbild auf den Bildschirm gezeichnet wird (-> Abb. 9.4.1, 9.4.2). Gleichzeitig erscheint das Bild des beweglichen Objektes, welches mit Hilfe der Maus bewegt werden kann. Die Startposition der Bewegung hat einen kleinen Offset zur Position des Objektes im Hintergrundbild, um zu verdeutlichen, daß es nun beweglich ist (-> Abb. 5.6.2 A,B).
3.) Das Objekt wird mit gedrückter Maustaste bewegt. Um dem Anwender die Bedienung zu erleichtern, findet die Bewegung der Objekte zwischen festen Start- und Endpunkten statt. Während der Bewegung ist der Cursor unsichtbar, damit das Bild des Objektes besser zu sehen ist und ein möglichst realistischer Eindruck entsteht.
4.) Berührt das Objekt die sensitive Zone eines Start- oder Endpunktes, so wird es an diesem Punkt vorläufig abgelegt. Wird die Maustaste losgelassen, so bleibt das Objekt an diesem Ruhepunkt. Bleibt die Maus aber gedrückt und wird aus der sensitiven Zone des Punktes bewegt, so wird das Objekt wieder aus dem Ruhepunkt herausgenommen und kann weiterbewegt werden.
5.) Wird die Bewegung vor dem Erreichen abgebrochen, bewegt sich das Objekt selbsttätig zur Startposition zurück.

Abb. 5.6.2: Bewegung eines Objektes. Über einem beweglichen Objekt wird der Cursor zu einer offenen Hand (A). Duch Drücken der Maustaste wird das Objekt gegriffen (B) und mit gedrückter Taste über den Bildeschirm bewegt (C). Berührt es die sensitive Zone eines anderen Ruhepunktes, so wird es dort abgelegt (D).
Bei der Konzeption der Bewegungsanimation wurde darauf geachtet, daß diese möglichst allgemein gehalten ist, um sie in allen drei Programmen und evtl. weiteren Programmen einsetzen zu können. So wurden in dieser Animation einige spezielle Fähigkeiten realisiert:
Die Endpunkte der Bewegung können beweglich sein.
Da im Programm SimVessel Gewichte an einen beweglichen Haken gehängt werden, wurde bei der Konzeption berücksichtigt, daß die Start- und Endpunkte der Bewegung im allgemeinen Fall beweglich sein können. Im Programm SimVessel macht der Haken, an den die Gewichte gehängt werden, eine vertikale Bewegung, die von der Muskelkontraktion gesteuert wird. Die Relativbewegung zwischen dem Gewicht und dem Haken hängt also auch von der Bewegung des Hakens ab.
Ein Objekt kann mehrere Endpunkte haben.
In dem Programm SimHeart können die Reagenzgläser in einer von zwei Öffnungen des Perfusors abgelegt werden. Aus diesem Grunde wurde in der Funktion die Möglichkeit integriert mehrere Endpunkte pro Objekt zu verwalten.
Mehrere Objekte können einen gemeinsamen Endpunkt haben.
In den Programmen SimVessel und SimMuscle kann wahlweise einer von zwei Muskeln in die Versuchsapparatur gehängt werden. Dieses wurde ebenfalls realisiert.
Ruhepunkte können mehrfach belegt werden (Stapelung).
In den Programmen SimMuscle und SimVessel benutzen die Gewichte gemeinsame Start- bzw. Endpunkte. Es handelt sich um eine First-In-Last-Out-Mehrfachbelegung, wie sie im allgemeinen beim Stapeln auftritt.
Objekte können durch einen Dateieintrag gesperrt werden.
In den Programmen SimHeart und SimVessel ist die Möglichkeit gegeben einige Verdünnungen einer bestimmten Substanz durch einen Eintrag in die entsprechende Datei (labor-Heart.preferences bzw. labor-Vessel.preferences) zu sperren. Dieses kann dazu benutzt werden, bei der Versuchsdurchführung ausschließlich die im Chemielabor angesetzten Verdünnungen zur Verfügung zu stellen. Außerdem können so einige Substanzen vom Versuchsleiter aus dem Praktikum genommen werden.
Bei der Konzeption der Bewegungsanimation wurde außerdem darauf geachtet, daß sie möglichst leicht an verschiedene Versuchsumgebungen angepaßt werden kann. Dieses soll am Beispiel von SimVessel gezeigt werden. Die relevanten Parameter der Datei B_MoveObjects.c sind:
//-------------------- Defines ------------------//
#define MOVE_PICTS_START_ID 1300
#define MOVE_OBJECTS 8 // 2 Muskel, 4 RGläser, 2 Gewichte
#define END_PUNKTE 4 // Muscle, 2xOese, RGlas
#define RGLAS_AVAIL_START_ID 150 // in diesen Strings stehen verfügbare Konz.
//---------------- Bezeichnungen ---------------//
enum{ rGlas0, rGlas1, rGlas2, rGlas3, muscle0, muscle1, weight0, weight1 }; // Objekte
enum{ StartPos, EndPos, MoveVis, MoveInvis, Sperr }; // Status
enum{ EndPkt_Mus, EndPkt_W1, EndPkt_W2, EndPkt_RGlas }; // EndPunkte
//------------------- Parameter -----------------//
short gStatus[ MOVE_OBJECTS ] = { Sperr, StartPos, StartPos, StartPos, StartPos, StartPos,
StartPos, StartPos };
Boolean gEndFree[ END_PUNKTE ] = { TRUE, TRUE, TRUE, TRUE };
short gVertChangePictOffset_e[ MOVE_OBJECTS ] = {0,0,0,0,0,0,0,0}; // Bew. der Endpkte
short gChangePict_s_out[ MOVE_OBJECTS ] = { RGlas_1_s_out, RGlas_2_s_out, RGlas_3_s_o, RGlas_4_s_out, Mus1_s_out, Mus2_s_out, W1_s_out, W2_s_out };
short gChangePict_e_out[ MOVE_OBJECTS ] = { RGlas_e_out, RGlas_e_out, RGlas_e_out, RGlas_e_out, Mus12_e_out, Mus12_e_out, W1_e_out, W1_e_in_W2_e_out };
short gChangePict_s_in[ MOVE_OBJECTS ] = { RGlas_1_s_in, RGlas_2_s_in, RGlas_3_s_in, RGlas_4_s_in, Mus1_s_in, Mus2_s_in , W1_s_in, W1_s_out_W2_s_in };
short gChangePict_e_in[ MOVE_OBJECTS ] = { RGlas_1_e_in, RGlas_2_e_in, RGlas_3_e_in, RGlas_4_e_in, Mus12_e_in, Mus12_e_in, W1_e_in_W2_e_out, W2_e_in };
short gStartLefts[MOVE_OBJECTS] = { 357, 397, 437, 477, 20, 20, 200, 200 };
short gStartTops[MOVE_OBJECTS] = { 40, 40, 40, 40, 300, 350, 20, 20 };
short gEndLefts[MOVE_OBJECTS] = { 282, 282, 282, 282, 70, 70, 140, 140 };
short gEndTops[MOVE_OBJECTS] = { 65, 65, 65, 65, 200, 200, 100, 110 };
short gConnect2End[ MOVE_OBJECTS ] = { EndPkt_RGlas, EndPkt_RGlas, EndPkt_RGlas, EndPkt_RGlas, EndPkt_Mus, EndPkt_Mus, EndPkt_W1, EndPkt_W2 };
Um die Animation der beweglichen Objekte an eine neue Versuchsumgebung anzupassen, werden zunächst die Bilder der Objekte und die Hintergrundbilder in das eintsprechende Resource-File (labor-Heart.
π.rsrc, labor-Vessel.π.rsrc und muscle.π.rsrc) geladen.
Nach dem Einfügen der Bilder müssen folgende Konstanten angepaßt werden:
Die Konstante MOVE_PICTS_START_ID legt die Start-ID der Objektbilder in dem Resource-File fest.
Die Konstante MOVE_OBJECTS definiert die Anzahl der beweglichen Objekte fest.
END_PUNKTE definiert die Anzahl der Endpunkte. Die Anzahl der Startpunkte ist immer gleich der Anzahl der beweglichen Objekte.
RGLAS_AVAIL_START_ID bestimmt die ID des Strings, der die Information Substanzen enthält.
Einige Variablen dieser Funktion werden beim Start des Programms durch Konstanten initialisiert (s.o.). Die in dieser Funktion verwendeten Variablen haben folgende Bedeutung:
In gStatus kann der Zustand der Objekte nach dem Start des Programms festgelegt werden (z.B. ob sich ein Objekt am Start- oder Endpunkt befindet oder ob es gesperrt ist).
In gEndFree wird eingetragen, welche Endpunkte nach dem Start des Programms belegt und welche frei sind.
Die Variable gVertChangePictOffset_e dient zum Speichern der vertikalen Ablenkung der Endpunkte, falls diese eine Bewegung ausführen können. Diese Variable wird nur im Programm SimVessel mit von Null verschiedenen Werten initialisiert.
Die Variablen gChangePict_s_out, gChangePict_e_out, gChangePict_s_in und gChangePict_e_in enthalten die Nummer der Hintergrundbilder, die bei den jeweiligen Aktionen auf den Bildschirm gezeichnet werden. gChangePict_s_out bezieht sich auf das Herausnehmen der Objekte aus den Startpunkten, gChangePict_e_out auf das Herausnehmen der Objekte aus den Endpunkten, gChangePict_s_in auf das Ablegen der Objekte an den Startpunkten und gChangePict_e_in auf das Ablegen an den Endpunkten. Anstelle der Bildnummern können auch die in den Header-Dateien definierten Namen der Bilder verwendet werden.
Die Variablen gStartLefts, gStartTops, gEndLefts und gEndTops definieren den Ort, an dem sich das Objekt nach dem Herausnehmen aus den Start- bzw. Endpunkten befindet.
Die Variable gConnect2End verknüpft die Objekte mit den Endpunkten.
Normalerweise können mehrere Animationen parallel ablaufen, ohne daß sie sich störend beeinflussen, da jede einen anderen Bildschirmbereich benutzt. Bei der Bewegungsanimation kann es aber vorkommen, daß ein Objekt über eine andere Animation bewegt wird, was im Allgemeinen zu Störungen beider Animationen führt. Dieses kann folgendermaßen verhindert werden:
Einschränkung der Beweglichkeit des Objektes.
In diesem Fall wird die Bewegung des Objektes eingeschränkt (z.B. nur horizontal oder innerhalb eines definierten Bildschirmbereiches), so daß sich die Animationen nicht überlagern können. Diese Lösung hat den Nachteil, daß sie einen unrealistischen Eindruck vermittelt. Aus diesem Grunde wurde auf eine Einschränkung der Bewegung verzichtet.
Einschränkung des sichtbaren Bereiches des Objektes: die NoGo-Zone.
Durch Definition einer Zone, die bei der Bewegung des Objektes ausgeblendet wird, kann das Objekt hinter anderen Objekten bewegt werden. Auf diese Weise wird eine Überlagerung der Animationen ebenfalls ausgeschlossen. Diese Lösung ist aber nicht in jedem Fall möglich, da die Anordnung und Verbindung der Geräte untereinander dazu führen würde die Zone entsprechend zu vergrößern. Dieses kann dazu führen, daß die NoGo-Zone zu groß wird und eventuell einige Zielpunkte nicht mehr erreichbar sind. Da diese Lösung weniger Rechenzeit in Anspruch nimmt als die Anpassung der Animationen aneinander (s.u.), wurde sie benutzt, um zu vermeiden, daß der Schreiber von beweglichen Objekten überfahren wird.
Anpassung der Animationen aneinander.
Die eleganteste aber auch aufwendigste Lösung ist das Anpassen der Animationen aneinander. Durch spezielle Funktionen werden die Umrisse der Objekte einer Animation anderen Animationen mitgeteilt, so daß diese durch entsprechendes Clipping und Nachzeichnen wieder sichtbar gewordener Teile auf eine Überlagerung reagieren können.
Das Überfahren der Blasenanimationen und der Muskelanimationen in SimVessel und SimHeart und der Uhr-Animation in SimVessel wurde auf diese Weise ermöglicht.
Aus Geschwindigkeitsgründen mußte, wie bereits erwähnt, bei dem Schreiber auf eine Offscreen-Kopie des beweglichen Papierauschnittes verzichtet werden, da dieses die Animation erheblich verlangsamt hätte. Die Animation findet also direkt auf dem Bildschirm statt. Die Konsequenz davon ist, daß Objekte nicht über das Papier des Schreibers gezogen werden dürfen, weil der von dem Objekt verdeckte Papierhintergrund nicht regenerierbar ist. Eine Lösung dieses Problems ist die Einführung einer NoGo-Zone, hinter der das Objekt verschwindet.
Eine Maske der Region liegt in der entsprechenden Resource-Datei vor. Die Funktion Z_LoadPict() berechnet daraus die NoGo-Region.
Die NoGo-Region kann aber auch dazu benutzt werden den Eindruck der Räumlichkeit zu erhöhen.
Die Schieberegler sind ein Spezialfall der Bewegungsanimation. Die Bewegung findet entweder auf einer horizontalen - (Schieberegler des Stimulators in SimMuscle) oder einer vertikalen Linie (Schieberegler des Oszilloskopes in SimMuscle und des Schreibers in SimVessel und SimHeart) statt. Zudem ist die Bewegung auf den Bereich der Regler eingeschränkt.
5.7 Der Algorithmus von SimMuscle
In den Simulationsprogrammen reagieren die virtuellen Muskeln auf die vom Anwender eingestellten Versuchsbedingungen und verabreichten Stimuli. Die Programme berechnen anhand von mathematischen Beschreibungen (Algorithmen) die entsprechenden Messwerte, die für die Darstellung der Muskelkontraktion auf den Ausgabemedien (Oszilloskop bzw. Schreiber) und für die visuelle Animation der Muskeln notwendig sind.
Im Rahmen dieser Arbeit wurde aus einem einfachen Modell ein Algorithmus zur Simulation der Kontraktion eines Skelettmuskels entwickelt. Bei der Realisierung wurde im Besonderen auf folgende zwei Punkte geachtet:
Die mathematische Beschreibung muß die Realität hinreichend genau wiedergeben.
Um das Echtzeitverhalten des Programms zu gewährleisten, muß sie hinreichend schnell sein.
Die kleinste kontraktile Einheit eines Skelettmuslels ist das Sarkomer (-> Abb. 3.1.2). In ihm wird chemische Energie in Form von ATP in mechanische Energie (und Wärme) umgewandelt. Die gesamte Kraft, die der Muskel einer äußeren Kraft entgegenstellt, setzt sich aus zwei Anteilen zusammen:
der aktiven Muskelspannung, die der Muskel mit Hilfe seiner kontraktilen Elemente während der Kontraktion erzeugt und
der passiven Muskelspannung, die die elastischen Elemente bei Dehnung des Muskels der äußeren Kraft entgegenstellen (Ruhedehnung).
Die Kurve der isotonischen Kontraktionsmaxima (-> Abb. 5.7.1 Kurve b) gibt die Gesamtspannung des Muskels, bei entsprechender Vordehnung wieder:

Abb. 5.7.1: Bezeihung zwischen Belastung und Verkürzung eines Froschmuskels entnommen aus [23]. Die Belastung des ruhenden Muskels führt zur Ruhedehnungskurve (c). Die Ruhelänge des Muskels liegt bei 2.5 cm. Bei isotonischen Kontraktionen, verkürzt sich der Muskel bei konstantem Gewicht und erreicht die Kurve der isotonischen Maxima (b). Diese Kurve kann in guter Näherung durch eine Gerade angenähert werden (in der Abbildung grau gezeichnet). Die Kurve der Maxima der isotonische Unterstützungskontraktion ist in (a) dargestellt.
Wird der Muskel stark vorgedehnt, nähert sich die Kurve der isotonischen Kontraktionsmaxima der Ruhedehnungskurve des Muskels an. Aufgrund des passiven Anteils nimmt die Muskelkraft in diesem Bereich sehr schnell mit der Dehnung des Muskels zu.
Im Bereich kleiner und mittlerer Vordehnungen kann die Gesamtspannung durch eine Gerade angenähert werden (-> Abb. 5.7.1). Dieser lineare Kraftverlauf entspricht dem einer idealen Metallfeder:
F = k*X
Dabei ist X die Auslenkung der Feder aus der Ruhelage und k die Federkonstante.
Neben den kontraktilen Elementen sind im Muskel auch dämpfende Anteile vorhanden, die der Bewegung des Muskels entgegengestellt sind und die Umwandlung von Bewegungsenergie in Wärme bewirken (Reibungsverluste). Die Dämpfung ist bei schneller Verkürzung des Muskels höher aus bei langsamer. In erster Näherung wird sie als proportional zur Verkürzungsgeschwindigkeit angenommen:
F = ß * dX/dt
In erster Näherung kann ein Sarkomer als Parallelschaltung von kontraktilen und dämpfenden Elementen angesehen werden. Für einen Skelettmuskel ergibt sich somit folgendes Modell:

Abb. 5.7.2: Modell eines Skelettmuskels als Parallel- und Reihenschaltung dämpfender und elastischer Elemente.
Mit Hilfe der Additionsregeln für Federn, die auch auf die parallelgeschalteten dämpfenden Elemente anzuwenden sind, vereinfacht sich das Modell des Skelettmuskels zur Parallelschaltung einer Feder mit effektiver Federkonstante und einem dämpfenden Element mit effektiver Dämpfungskonstante:

Abb. 5.7.3: Modell eines Skelettmuskels. Der Muskel wird durch eine Parallelschaltung dämpfender und kontraktiler Elemente angenähert.
Mathematisch kann das in Abb. 5.7.3 dargestellte System durch die Bewegungsgleichung einer geschwindigkeitsproportional gedämpften Schwingung beschrieben werden:
m*d2X/dt2 + ß*dX/dt + k*X - mg = 0
Dabei sind m die effektive Masse des Systems (effektive Muskelmasse plus Masse des Gewichtes), g die Gravitationskonstante (9.81 N/kg), k die Federkonstante der kontraktilen Elemente, ß
die Dämpfungskonstante und X die Auslenkung des Systems aus der Ruhelage.
Mit den Definitionen:
X0 = X(t0)
V0 = dX/dt(t0)
d = ß/2m
A = ( 1/w ) * ( V0 + d*X0 )
B = X0
w = ( (k/m)2 - d2 )1/2
w'= ( d2 - (k/m)2 )1/2
D = ß/(mk)1/2 (relative Dämpfung)
ergeben sich die allgemeinen Lösungen dieser Bewegungsgleichung in Abhängigkeit von der relativen Dämpfung (D) zu [7]:
1.) Für den Fall, daß die relative Dämpfung kleiner als zwei ist, ergibt sich die die periodische, gedämpfte Schwingung:
X = e-dt(A*sin(wt) + B*cos(wt)) + mg/k
2.) Ist D gleich zwei, so tritt der aperiodische Grenzfall auf:
X = [ (V0 + d*x0)*t + x0 ]*e-dt + mg/k
3.) Bei einer relativen Dämpfung größer als zwei ergibt sich der aperiodische Kriechfall:
X = e-dt[(1/w')(V0+d*X0)sinh(w't) + X0*cosh(w't)] + mg/k
Zur Beschreibung der Kontraktion eines Muskels werden folgende Anfangsbedingungen gewählt:
die Auslenkung x zu Beginn der Zuckung ist gleich Null (X0=0).
Die Verkürzungs-Geschwindigkeit zu Beginn der Kontraktion (V0) entspreche der des realen Muskels (ansteigende Flanke der Kontraktionskurve zu Beginn der Zuckung).
Mit diesen Anfangsbedingungen ergeben sich z.B. folgende graphisch dargestellte Lösungen der Differentialgleichung:

Abb. 5.7.4: Beispiele der drei Lösungen der Bewegungsgleichung einer gedämpften Schwingung: Im Fall ß<2 ergibt sich eine periodische, gedämpfte Schwingung; bei ß=2 der aperiodische Grenzfall und im Fall ß>2 der aperiodische Kriechfall.
Der Algorithmus wurde auf folgende Weise an die realen Kontraktionskurven angepaßt (-> Abb. 5.7.6):
Anpassungen der simulierten Kurven an Messungen von realen Muskeln ergaben eine relative Dämpfung zwischen 1.2 und 1.8 in Abhängigkeit von der Masse, mit der der Muskel belastet wird und der Ermüdung des Muskels (s.u.).
Die Lösungen der o.g. Differentialgleichung nähern sich asymptotisch der Null-Linie an, verschwinden aber nie ganz. Bei der Kontraktionskurve eines realen Muskels wird dieses nicht beobachtet. Außerdem zeigt die Lösung der Differentialgleichung, für den Fall, daß die relative Dämpfung kleiner als zwei ist, Nachschwingverhalten (periodische, gedämpfte Schwingung). Dieses Verhalten ist ebenso untypisch für die Kontraktion eines realen Muskels.
Beide Probleme können auf einfache Weise beseitigt werden, indem der Definitionsbereich der Funktion auf den Bereich zwischen den ersten beiden Nullstellen eingeschränkt wird. Dieses Vorgehen hat noch einen anderen Vorteil. Da man der Kurve eine genau definierte "Kontraktionsdauer" zuordnen kann, muß der Algorithmus nur während der Kontraktionsdauer des Muskels berechnet werden. Dadurch wird die Berechnung erheblich beschleunigt.
Die Dauer einer Zuckung wird ebenfalls an reale Werte (190-270 ms) in Abhängigkeit von der Ermüdung, der Gewichtsbelastung und der Kontraktionsart angepaßt.
Erfolgt ein zweiter Reiz zu einem Zeitpunkt, an dem die erste Zuckung noch nicht abgeklungen ist, so überlagert sich die zweite Zuckung auf den Kontraktionsrückstand nach der ersten. Durch die Summation der Einzelzuckungen nehmen sowohl die Spannungsmaxima, als auch die Kontraktionsrückstände der nachfolgenden Zuckungen zu, obwohl der intrazelluläre Kalziumspiegel zwischen den Zuckungen, fast wieder auf den Ruhewert zurückgeht [23].
Wird die Frequenz der Reizimpulsen erhöht (z.B. >15 Hz), so bleibt der intrazelluläre Kalziumspiegel auch zwischen den Reizen erhöht. Der Muskel kontrahiert tetanisch. Die Kontraktionsmaxima nehmen mit der Reizfrequenz zu, bis die maximale Kontraktion bei sehr hohen Frequenzen (z.B. >50 Hz) erreicht wird. Dieses Maximum (Xmax ) ist etwa 2-3 mal so hoch, wie das einer Einzelzuckung.

Abb. 5.7.5: Die Überlagerung von zwei Zuckungen kann mathematisch durch die gewichtete Addition zweier Einzelzuckungen simuliert werden. Xmax bezeichnet die maximal erreichbare (tetanische) Kontraktion; Xges(t) den zeitlichen Verlauf der Kontraktion des Muskels bei Mehrfachreizung. Die Zeitpunkte der Einzel-Kontraktionen sind als t1 und t2 bezeichnet.
Mathematisch kann dieses Verhalten durch die gewichtete Addition zeitlich verschobener Einzelzuckungen simuliert werden:
Xges(t) = A1*X1(t-t1) + A2*X2(t-t2) + ... + An*Xn(t-tn)
Ai = [Xmax - Xges(ti)]/Xmax , i=1...n
Dabei sei n die Anzahl der Zuckungen, Xmax die maximale Kontraktion und ti die Zeitpunkte der Stimulationen.
Die Kurven, die der Algorithmus bei Mehrfachreizung des Muskels generiert, können ebenfalls an reale Kurven angepaßt werden:
Die oben angegebene Gleichung hat einen Freiheitsgrad in der Wahl des Normierungsfaktors xmax. Mit Hilfe dieses Faktors kann das Verhältnis der Einzelzuckung zu den tetanischen Kurven eingestellt werden. Je größer der Faktor ist, desto stärker wächst das Kontraktionsmaxima der tetanischen Kontraktionskurven.
Wie bei einem realen Muskel, so weist auch der virtuelle Muskel Ermüdungserscheinungen auf. Die Ermüdung kann in erster Näherung in zwei Anteile zerlagt werden: einen reversiblen und einen irreversiblen Anteil. Die reversible Ermüdung kann (unter der Annahme, daß der Muskel während des Experimentes mit Nährlösung versorgt wird) durch eine Erholungszeit wieder reduziert werden. Der irreversible Anteil führt unwiederbringlich zur Verminderung der Muskelleistung, bis hin zur totalen Ermüdung. Um die Durchführung des Versuches zu erleichtern ist die irreversible Ermüdung des virtuellen Muskels im Vergleich zum realen erheblich geringer.
Die Ermüdungsfunktionen nehmen mit der Reizstärke, der Gewichtsbelastung und vor allem mit der Anzahl der Zuckungen zu. Die Gesamtermüdung des Muskels (Addition aus reversibler- und irreversibler Ermüdung) beeinflußt einige der Parameter des Algorithmus:
Die Normierungsfaktoren der Einzelzuckung und der maximalen Kontraktion (xmax ) werden mit der Ermüdungdes Muskels vermindert - die Kontraktionsstärke nimmt ab.
Die Kontraktionsdauer der Grundfunktion nimmt mit der Ermüdung zu.
Die relative Dämpfung der Grundfunktion steigt mit der Ermüdung.
Ebenso wie der reale Muskel, kann sich der simulierte Muskel teilweise wieder erholen. Die Erholungsfunktion geht über die (exponentielle) Reduzierung der reversiblen Ermüdung in den Algorithmus ein.
Trotz des einfachen Modells liefert der auf die oben angegebene Weise an die realen Kurven angepaßte Algorithmus sowohl bei Einzelzuckungen (-> Abb. 5.7.6) als auch bei Mehrfachreizung (-> Abb. 5.7.7) gute Ergebnisse:

Abb. 5.7.6: Die isotonische Einzelzuckung des virtuellen Skelettmuskels (rechtes Bild) im Vergleich zur Einzelzuckung eines realen Frosch-Skelettmuskels (linkes Bild). Der reale Muskel wurde mit einem Gewicht von 180 g, der virtuelle mit 150 g, vorgedehnt.
Die Zeit zum Erreichen des Maximums und die Zuckungsdauer der Kontraktionskurve des realen und des virtuellen Muskels stimmen gut überein. Der reale Muskel erreicht nach etwa 65 ms das Maximum, der virtuelle nach ca. 60 ms. Die Zuckungsdauer liegt in beiden Fällen bei ca. 230 ms. Abgesehen von dem etwas steileren Anstieg der simulierten Funktion, stimmen die Kurvenverläufe sehr gut überein.
Auch die Kurven bei Mehrfachreizung des Muskels spiegeln die Realität gut wieder:

Abb. 5.7.7: Die isotonische tetanische Kontraktion des virtuellen Skelettmuskels (unteres Bild) im Vergleich zur Einzelzuckung eines realen Frosch-Skelettmuskels (oberes Bild). Der Skelettmuskel wurde mit 30 g, der virtuelle Muskel mit 50 g. vorgedehnt.
Die simulierten Kurven entsprechen im Großen und Ganzen denen eines realen Skelettmuskels:
Die 5-Herz-Kurven zeigen beide auf Grund der zunehmenden Ermüdung der Muskeln eine leichte Verbreiterung und führen so sukzessiv zur Verschmelzung der Einzelzuckungen. Außerdem wird die Kontraktionstärke vermindert.
Die selben Effekte treten auch bei den 10-Herz-Kurven auf. Bei der simulierten Kurve sind sie weniger stark ausgeprägt, als bei der gemessenen Kurve. Insgesamt zeigt der virtuelle Muskel etwas schwächere Ermüdungserscheinungen als der reale. Um die Durchführung der Experimente zu erleichtern ist dieses erwünscht.
Die 30-Herz- und die 50-Herz-Kurven der Simulation liegen im Vergleich zu den beiden anderen Kurven etwas tiefer als bei den gemessenen Kurven.
Durch Erhöhung des Aufwandes (z.B. durch Einführen neuer Funktionen) könnte der Algorithmus immer weiter verbessert werden. Aus mehreren Gründen ist es jedoch sinnvoll den Aufwand nur bis zu einem gewissen Punkt zu treiben:
Da es sich bei den Programmen um Lernprogramme handelt, ist es nicht wichtig das gesamte Spektrum der realen Messkurven zu simulieren. Ziel ist es typische Kontraktionsverläufe von Skelettmuskeln, deren physiologischen Parameter in realistischen Bereichen variiert werden, zu generieren.
Mit der Komplexität steigt auch die Zeit zur Berechnung des Algorithmus. Dieses ist unerwünscht, da auf diese Weise das Echtzeitkonzept der Programme eingeschränkt würde.
Die Entwicklungszeit spielt bei der Realisierung von Projekten dieser Art natürlich auch eine wichtige Rolle.
Neben dem Einfluß der Reizfrequenz und der Impulsanzahl, wird die Kontraktionskurve des Muskels durch folgende Versuchsparameter beeinflußt:
Die Reizspannung,
die Ermüdung des Muskels,
die Vordehnung des Muskels und
die Kontraktionsart (isotonisch oder isometrisch).
Der Einfluß der Reizstärke, der Vordehnung und der Ermüdung des Muskels auf seine Kontraktionsstärke wird mathematisch durch Multiplikation der Kontraktionskurve mit drei Funktionen realisiert, welche jeweils von einem der drei Parameter (entsprechend den in 6.1 dargestellten exemplarischen Verläufen) abhängen.
Der Einfluß der Vordehnung auf die Zuckungsgeschwindigkeit und somit auch auf die Kontraktionsdauer wird ebenfalls berücksichtigt (-> Abb. 6.1.9).
Das in diesem Kapitel dargestellte Modell beschreibt die Verkürzung des Muskels unter isotonischen Versuchsbedingungen. Der daraus entwickelte Algorithmus läßt sich aber durch Anpassung der relativen Dämpfung (1.0 bis 1.6) auch zur Simulation des Kraftverlaufes bei isomerischen Kontraktionen anwenden.
5.8 Simulation des Rauschens
Im realen Versuch sind den Mess-Signalen auch unerwünschte Signale überlagert - das Rauschen. Es kann aus verschiedenen Komponenten zusammengesetzt sein:
elektrischens Rauschen auf Grund der Wärmebewegung der Atomkerne in den Leitern,
elektrischens Rauschen der Geräte (z.B. das 50 Hz Netzbrummen),
Einstrahlung von elektromagnetischen Fremdsignalen und
mechanische Einflüsse auf die Messapparatur.
Um die Simulationen möglichst realistisch erscheinen zu lassen, sind den simulierten Messkurven Rauschkurven überlagert. Diese Kurven lassen sich mit Hilfe der gleitenden Mittelung von Zufallswerten simulieren.
Bei der Berechnung des Rauschens mit Hilfe dieser Methode wird zunächst ein Zahlenvektor mit Zufallszahlen belegt. Diese Werte werden aus einem festgelegten Intervall genommen, daß durch die Konstante NOISE_AMP (SimMuscle und SimHeart) bzw. NOISE_AMP_VEKTOR (SimVessel) definiert ist.
Der Mittelwert der Zahlen ergibt den aktuellen Rauschwert in Millivolt. Bei jedem Aufruf der Funktion Rauschen() wird der Index der zu ändernden Zufallszahl (mit Hilfe des Zufallsgenerators) bestimmt und diese durch eine neue Zufallszahl ersetzt. Danach wird wieder der neue Mittelwert aller Zufallszahlen gebildet und so der neue Rauschwert ermittelt. Folgendes Beispiel soll die Berechnung des Rauschen verdeutlichen:

Durch die Anzahl der Elemente des Rauschvektors wird die Glättung des Rauschens bestimmt. Sie ist durch die Konstante GLATT (SimMuscle und SimHeart) bzw. GLATT_VEKTOR (SimVessel) definiert.
Um die Rauschfunktion an verschiedene Versuche anzupassen wurden die Rauschparameter in den drei Programmen unterschiedlich eingestellt. Außerdem wurden in den Programmen SimMuscle und SimVessel Variationsmöglichkeiten in den Rauschkurven realisiert.
Der Anwender muß in diesem Programm den Kraftaufnehmer und das Oszilloskop miteinander verkabeln. Ist die Verkabelung fehlerhaft, so hat das einen Einfluß auf die Stärke des Rauschens. Aus diesem Grunde wurden unterschiedliche Rauschkurven realisiert. Ein zusätzlicher Rauschfaktor (r), mit dem das Rauschen multipliziert wird, sorgt für die Variation der Rauschamplitude:
Tab. 5.6: Einstellungen des Rauschens in verschiedenen Situationen des Programms SimMuscle.
|
Situation |
r |
effektive Rauschamp. |
Bemerkung
|
|
richtig verkabelt |
0.01 |
1 |
geringes Rauschen durch größt-mögliche Rauschunterdrückung |
|
Kabel in falsche Buchse |
0.01 |
1 |
s.o. |
|
Power des Kraftaufnehmers aus |
0.04 |
4 |
stärkeres Rauschen, da aktive Rauschunterdrückung des Gerätes aus |
|
Kabel offen |
0.15 |
15 |
stärkstes Rauschen durch starke Einstrahlung von Fremdsignalen |
Die Einstellung der Rauschparameter in diesem Programm lautet:
#define NOISE_AMP 100 // konstante Rauschamplitude in mV
#define GLATT 10 // Glättung durch "gleitendes Mittel"
Im Programm SimVessel werden im Unterschied zu SimMuscle verschiedene Sätze von Rauschamplituden und Glättungen verwendet, um eine Variabilität in der Rauschkurve zu erreichen. Auf diese Weise wird nicht nur eine Variabilität in der Rauschstärke erreicht, sondern auch die Form der Rauschkurve verändert. Auf Grund des Aufbaus treten in diesem Versuch oft stärkere Fremdeinflüsse auf als bei den zwei anderen Versuchen, begünstigt durch:
den starken mechanischen Einfluß der Begasungsapparatur auf den Kraftaufnehmer und
das ungünstigere Verhältnis von Mess-Signalen zu den Störsignalen auf Grund der relativ kleinen Muskelstücke.
Die Konstante NOISE_VAR definiert die Anzahl der Rauschkurven. Jeder Rauschamplitude des Rauschamplitudenvektors (NOISE_AMP_VEKTOR) ist eine Glättungskonstante des Glättungsvektors (GLATT_VEKTOR) zugeordnet. Bei einem Wechsel der Muskeln wird per Zufallsgenerator eine andere Rauschkurve ausgewählt, da die Versuchsumgebung geändert wurde.
Die Einstellungen der Rauschparameter im Programm SimVessel lauten:
#define NOISE_VAR 4 // 4 Variationsmöglichkeiten
#define NOISE_AMP_VEKTOR { 3, 50, 10, 50 } // 4 x NOISE_AMP
#define MAX_GLATT 150 // maximale Glättung
#define GLATT_VEKTOR { 3, 50, 20, 100 } // 4 x GLATT

Abb. 5.8.1: Einfluß der Rauschamplitude und der Glättung auf die Rauschkurve am Beispiel von SimVessel. Die Rauschkurven wurden aufgezeichnet bei einer Schreibergeschwindigkeit von 20cm/min und einer Auflösung von 1mV/div.
In SimHeart sind die Rauschparameter folgendermaßen eingestellt:
#define NOISE_AMP 1 // Rauschen = -NOISE_AMP ... NOISE_AMP
#define GLATT 15 // Glättung durch "gleitendes Mittel"
5.9 Sonstige Animationen
5.9.1 Die Begasung einer Flüssigkeit
In den Programmen SimVessel und SimHeart wird die Ringerlösung mit einem Gemisch aus 95% Sauerstoff und 5% Kohlendioxid begast. Veranschaulicht wird die Begasung durch eine permanent ablaufende Animation. Während eines Durchlaufes der Echtzeitschleife wird die Animation einmal durchgeführt.
Dabei werden die bereits sichtbaren Blasen um eine bestimmte Pixel-Distanz (BUBBLE_SPEED) nach oben geschoben und im unteren Bereich des Blasenstrudels die neuen Blasen gezeichnet. Auf Grund dieser Technik muß der Hintergund des Blasenstrudels im Bereich der Animation einheitlich gefärbt sein. Die Anzahl der pro Schleifendurchlauf gezeichneten Blasen ist durch die Konstante BUBBLES_PER_LOOP definiert.
Im Programm SimVessel wird die Geschwindigkeit der Animation auch durch den Beschleunigungsfaktor, mit dem die Geschwindigkeit des gesamten Versuchsablaufes verändert werden kann, beeinflußt.
Außerdem mußte bei der Realisierung berücksichtigt werden, daß die Wasserkante des Messgefäßes während des Waschvorgangs nicht konstant ist.

Abb. 5.9.1: Bei der Blasen-Animation wird berücksichtigt, daß die Wasserkante während des Spülvorgangs variabel ist.
5.9.2 Spülen des Messbechers
Um die Konzentration des Anwenders nicht von den eigentlichen Versuchsinhalten abzuziehen, wurde Wert auf die Benutzerfreundlichkeit gelegt. Dem teilweise automatisch ablaufenden Spülvorgang des Messgefäßes wurde aus diesem Grunde der Vorzug gegenüber der manuellen Variante gegeben.
Das Spülen wird duch Maus-Klick auf das Auslaßventil des Messgefäßes gestartet. Der Rest läuft automatisch ab:
Das Auslaßventil öffnet sich und läßt die Flüssigkeit aus dem Becher fließen.
Ist der Becher leer, wird das Ventil automatisch geschlossen und danach das am Vorratsgefäß befindliche Ventil geöffnet. Dieses bleibt solange offen, bis das Gefäß wieder gefüllt ist.
Hat die Wasserkante des Organbades die 30ml-Markierung des Messbechers erreicht, wird es automatisch wieder geschlossen.
Die Schwierigkeiten bei dieser Animation lag darin, daß der Animation zwei andere Animationen überlagert sind, die Blasenanimation und die Muskelanimation. Außerdem mußte bei der Animation die Form des Gefäßes berücksichtigt werden. Gelöst wurde dieses Problem folgendermaßen:
In der Resource-Datei liegen zwei Bilder des Messbechers vor: ein Bild des vollständig gefüllten und eins des vollständig geleerten Bechers. Im Verlauf der Animation werden die entsprechenden Bildteile aus diesen beiden Bildern zusammengesetzt.

Abb. 5.9.2: Pixelmaps des Messbechers in gefülltem und geleertem Zustand. Während des Waschvorgangs des Messbechers, wird das Bild des Bechers aus diesen beiden zusammengesetzt.
In der Muskelanimation sind die Umrisse der einzelnen Muskelbilder bekannt, so daß diese Regionen durch entsprechendes Clipping vor dem Übermalen geschützt werden können. Auf diese Weise kann sich der Muskel während des Spülvorgangs weiterbewegen.
Die Information über die Höhe der sich während des Spülvorgangs verändernden Wasserkante wird der Blasenanimation übermittelt, so daß diese darauf reagieren kann.
5.9.3 Die Zeitraffer-Uhr
Die Versuche zur glatten Muskulatur laufen sehr langsam ab. Bei der Simulation (SimVessel) wurde deshalb die Möglichkeit realisiert, den Versuch um den Faktor zwei bzw. vier zu beschleunigen (d.h. die versuchsinterne Zeit läuft entsprechend schneller als die reale Zeit). Um immer die richtige Zeit messen zu können, ist eine Uhr dargestellt, die die versuchsinterne Zeit anzeigt.

Abb. 5.9.3: Die Zeitraffer-Uhr zeigt die versuchsinterne virtuelle Zeit an, welche in drei Geschwindigkeitsstufen ablaufen kann: Genauso schnell wie in der Realität, doppelt und vierfach so schnell.
Die Funktion watch() mißt die Zeit, die seit dem Start des Programms abgelaufen ist, wandelt sie in die versuchsinterne Zeit um und stellt diese auf dem analogen Ziffernblatt mittels dreier Zeiger dar.
5.9.4 Schalteranimation
Schalter sind die in interaktiven Programmen am häufigsten vorkommenden Elemente. Aus diesem Grund wurde darauf geachtet, daß alle in den drei Programmen verwendeten Schalter mit den selben Funktionen realisiert werden konnten und der Aufwand, die Animationen an ein anderes Programm anzupassen, minimiert wurde.
In der Funktion E_Button() sind alle verwendeten Schaltertypen der drei Labore zusammengefaßt. Insgesamt werden fünf verschiedene Typen verwendet:
QuickBack
Diese Schalter springen nach kurzer Zeit (definiert durch die Konstante QUICK_BACK_DELAY_TICKS) unabhängig von dem Loslassen der Maustaste wieder zurück (z.B. die Stimulus- und SingleSweep-Schalter des Oszilloskops in SimMuscle).
BackOnUp
Beim Drücken der Maustaste werden sie gedrückt und beim Loslassen der Maustaste wieder gelöst (z.B. ZeroAdjust-Schalter des Transducers in SimVessel).
Con1, Con2, ...
Bei verbundenen Schaltern einer Gruppe löst das Drücken eines Schalters das Herausspringen des zuletzt gedrückten aus (z.B. Single-Twin-Train-Schalter in SimMuscle). Es können mehrere Gruppen zusammenhängender Schalter gleichzeitig definiert werden.
Permanent
Bei diesen Schaltern gibt es zwei Zustände, gedrückt und nicht gedrückt. Ein Mausklick wechselt von dem einen in den anderen (z.B. alle Powerschalter ).
OnTriggerUp
Das Lösen des Schalters kann nur durch das Drücken eines anderen Schalters bewirkt werden (z.B. Der Startschalter des Perfusors in SimHeart kann nur durch den Stop-Schalter gelöst werden).
Die Funktionen für die Animation der Schalter sind in den Dateien E_Buttons.c der drei Projekte zusammengefaßt. Mit ihrer Hilfe können auf folgende Weise Schalter realisiert werden:
Zunächst werden die Bilder der Schalterzustände in das entsprechende Resource-File eingebunden
Um sie leichter handhaben zu können, werden die Namen der Bilder und die Orte an denen sie auf dem Bildschirm gezeichnet werden sollen, in der entsprechenden Headerdatei definiert.
In der Datei E_Buttons.c werden die Namen der Bilder in die Vektoren gPictOnUp bzw. gPictOnDown eingetragen, je nachdem ob sie den gedrückten oder gelösten Zustand zeigen. Der Vektor gBType definiert den Typ des Schalters. Die Vektoren gSoundOnUp und gSoundOnDown definieren den Sound, den die Schalter bei der jeweiligen Aktion auslösen. Die Variable gBStatus legt fest, ob ein Schalter nach dem Start des Programms gedrückt oder gelöst ist und der Vektor gButtonWindow definiert das Fenster in dem der Schalter aktiv ist (nur in SimVessel und SimHeart). In den Konstanten NR_BUTTONS wird die Anzahl der Schalter eingetragen und in der Konstante NR_CONNECTION_GROUPS die Anzahl der Gruppen zusammenhängender Schalter. In der Zeile "enum{...}" befinden sich die Namen der Schalter. Auf diese Namen kann in der Funktion ActionOnDown() bezug genommen werden. Diese Funktion definiert die Aktionen, die beim Drücken der einzelnen Schalter ausgelöst werden sollen.
5.9.5 Drehregler
Die Drehregler werden mit Hilfe von zehn Bildern animiert, welche je nach Schalterstellung auf den Bildschirm gezeichnet werden:

Abb. 5.9.4: Die Bilder der Drehreglerstellungen und ihre Maske.
Um die Beschriftungen der Drehregler nicht zu übermalen, wird beim Zeichnen der Bilder eine Maske verwendet (-> Abb. 5.9.4). Beim maskierten Zeichnen wird nur die Fläche des Bildes auf den Bildschirm copiert, wo die Maske schwarz ist.
Die HotRegion der Drehregler geht soweit über die maskierte Fläche hinaus, daß er auch durch einen Mausklick auf die Skalierung bedient werden kann:

Abb. 5.9.5: Die HotRegions der Drehregler am Beispiel von SimVessel.
Klickt der Anwender auf die HotRegion, so wird die Mausposition in die Polarkoordinaten des in Abb. 5.9.6 dargestellten Koordinatensystems umgewandelt und die Schalterstellung, die dem berechneten Winkel am nächsten kommt, ermittelt. Bei jedem Aufruf der Funktion Drehregler() wird der Regler in die entsprechende Richtung um maximal eine Position weitergedreht, bis diese Schalterstellung erreicht ist.

Abb. 5.9.6: Die Winkel der Drehregler Stellungen.
Ist der Drehregler aktiv (d.h. die Maus befindet sich in der HotRegion des Drehreglers), so wird die Funktion Drehregler() bei jedem Durchlauf der Hauptschleife (also alle 80ms) einmal aufgerufen, so daß die Schaltvorgänge hinreichend schnell ablaufen.
Auf Grund dieses Konzeptes können die Drehregler auf zweifache Weise bedient werden:
Durch Drücken und Halten der Maustaste an der gewünschten Schalterposition schaltet er schrittweise in diese Stellung.
Ist diese Position erreicht, so kann er mit gedrückter Maustaste durch Verschieben der Maus weitergedreht werden.
5.9.6 Die tropfende Nährlösung
Bei dem Langendoff'schen Herzmuskelversuch wird das isolierte Herz über die Aorta mit Nährlösung perfundiert. Dabei schließen sich die Aortenklappen und die Flüssigkeit muß ihren Weg durch die Coronararterien nehmen. Nach Durchfließen des Coronargefäßsystems fließt das Perfusat aus dem Sinus coronarius bzw. dem eröffneten rechten Vorhof ab.
Die Animation der vom Muskel tropfenden Nährlösung ist in zwei Phasen aufgeteilt:
1.) Der Tropfen haftet am Muskel und wird langsam größer.
2.) Der Tropfen löst sich vom Muskel und fällt nach unten.
Eine wichtige Größe, die zu Beginn dieser Animation berechnet werden muß ist der Ort der unteren Kante der einzelnen Muskelbilder. Da der Muskel am oberen Ende fest aufgehängt ist, kann sie durch die Position der Aufhängung und die Höhe der Bilder bestimmt werden.
In der ersten Phase ist die Position des Tropfens eng an die Position der unteren Kante des Muskels gebunden. Die periodische Bewegung des Muskels führt somit auch zu einer periodischen Bewegung des Tropfens. Die Startposition eines neuen Tropfens ist so gewählt, daß die untere Kante des Tropfens einige Pixel höher liegt als die untere Kante des Muskels. Da die Fläche des Muskels beim Zeichnen des Tropfens mittels Clipping ausgenommen ist, ist der neue Tropfen also anfangs nicht zu sehen. Im Verlaufe der Animation sinkt die untere Kante des Tropfens Pixel für Pixel im Verhältnis zu der des Muskels, so daß der Tropfen am unteren Rand des Muskels sichtbar wird und langsam an Größe zunimmt.
Ab einer bestimmten Größe löst sich der Tropfen vom Muskel und fällt zu Boden. Dabei führt er eine gleichmäßig beschleunigte Bewegung aus, d.h. die zurückgelegte Strecke wächst quadratisch mit der Zeit.
6 Ergebnisse der Simulationen
In allen drei Programmen reagieren die virtuellen Muskeln auf die vom Anwender eingestellten Versuchsbedingungen und verabreichten Stimuli.
Um die Realitätsnähe der Ergebnisse zu erhöhen, sind alle Muskelparameter mit einer Varianz versehen. Beim Start der Programme werden sie mit Hilfe des Zufallsgenerators festgelegt. Die im folgenden dargestellten Kurven sind also als exemplarisch zu betrachten.
6.1 Ergebnisse von SimMuscle

Abb. 6.1.1: Eichung des Kraftaufnehmers in SimMuscle. Der Muskel wird in die Messapparatur gehängt und sukzessive mit Gewichten zu je 0.5N belastet (linkes Bild). Die der Gewichtskraft entsprechende Spannung wird auf dem Oszilloskop dargestellt (rechtes Bild). Der Eichfaktor zwischen der zu messenden Kraft und der Mess-Spannung beträgt 50mV/N.
Die Eichung des Kraftaufnehmers kann mit Hilfe der sechs Gewichte durchgeführt werden (-> Abb. 6.1.1). Jedes Gewicht wiegt 50 Gramm. Dieses entspricht einer Gewichtskraft von ca. 0.5 Newton. Die Gewichte werden dabei nacheinander an den Muskel gehängt, ohne daß der Nullabgleich des Messwandlers betätigt wird. Der durch das Gewicht entstandene Offset kann durch Betätigung des Single-Sweep-Knopfes oder des Stimulus-Knopfes auf dem Oszilloskop dargestellt werden.
Die Eichung des Längenaufnehmers wird auf ähnliche Weise vorgenommen:

Abb. 6.1.2: Eichung des Längenaufnehmers in SimMuscle. Der Muskel wird in die Messapparatur gehängt und sukzessive mit Gewichten belastet, so daß er sich gemäß seiner Ruhedehnung verlängert (linkes Bild). Die der Längenänderung entsprechende Spannung wird auf dem Oszilloskop dargestellt (rechtes Bild). Der Eichfaktor zwischen Längenänderung und Mess-Spannung ist 50mV/mm.
Durch Belastung des Muskels mit Gewichten wird dieser vorgedehnt. Dadurch entsteht ein Spannungsoffset am 'Length'-Ausgang des Messwandlers, der durch das Oszilloskop angezeigt werden kann. Zur Messung der Längenänderung des Muskels dient das an dem Messwandler vorhandene Lineal.
Jede Muskelfaser des Muskels ist mit einer oder mehreren Nervenendplatten versehen [6]. Für Einzelfasern gilt das Alles-oder-Nichts-Gesetz: Unterschwellige Reize lösen kein Aktionspotenzial aus. Sobald aber eine bestimmte Reizschwelle überschritten ist, entsteht ein Aktionspotential, daß über die gesamte Zelle geleitet wird und zur maximalen Zuckung der Einzelfaser führt [23].
In einem Skelettmuskel sind die Muskelfasern parallel zueinander angeordnet, so daß sich ihre Kontraktionskraft addiert. Die Stärke einer Einzelzuckung wird von der Anzahl, der an der Kontraktion beteiligten Fasern bestimmt. Da der Nerv gezeizt wird, hängt dieses wiederum von der Anzahl der überschwellig gereizten Nervenfasern ab.
Im Programm SimMuscle wird der Nerv des Muskels mit einer festen Reizdauer von 1ms gereizt. Bei fester Reizdauer ist die Stärke einer Einzelzuckung eine Funktion der Reizstärke (-> Abb. 3.1.6).
Die Durchführung dieses Versuchsteils mit dem Simulations-Programm SimMuscle führte zu folgender Beziehung zwischen Reizstärke und Kontraktionsmaximum:

Abb. 6.1.3: Einfluß der Reizspannung auf die Kontraktionsstärke des simulierten Skelettmuskels. Das linke Bild zeigt den Bildschirm des Oszilloskops. Die Reizstärke wurde beginnend bei 50mV sukzessive um 50mV erhöht. Das rechte Bild zeigt die Auswertung der Mess-Spannung.
Der sigmoidale Verlauf kann auf folgende Weise erklärt werden:
Unterhalb einer Mindestspannung (in diesem Fall etwa 80 mV) wird kein Aktionspotential in dem Nerv ausgelöst und somit auch keine Kontraktion des Muskels.
Dieser Spannungswert hängt stark von den Versuchsbedingungen ab z.B. von der Länge des Nerven zwischen den Elektroden, dem Spannungsverlust auf Grund des Kontaktwiderstandes zwischen Elektroden und Nerv, und von Leckströmen auf der Nervoberfläche [23].
Aus diesem Grunde ist er auch in der Simulationsrechnung mit einer großen Varianz versehen.
Wird der Nerv mit Reizstärken gereizt, die oberhalb der Mindestspannung sind, nimmt die Anzahl der oberschwellig gereizten Nervenfasern zunächst zu.
Sind schließlich alle Nervenfasern rekrutiert, führt eine weitere Erhöhung der Reizspannung zu keiner Verstärkung der Muskelkontraktion.
Erfolgt ein zweiter Reiz zu einem Zeitpunkt, an dem die erste Zuckung noch nicht abgeklungen ist, so überlagert sich der nachfolgende Reiz auf den Kontraktionsrückstand nach der ersten Kontraktion. Durch die Superposition der Einzelzuckungen nehmen die Spannungsmaxima mit der Frequenz der Doppelreize zu:

Abb. 6.1.4: Einfluß der Reizfrequenz auf die Kontraktionsstärke des simulierten Skelettmuskels bei Doppelreizung. Das Bild zeigt den Bildschirm des Oszilloskops. Es wurde mit folgenden Reizfrequenzen stimuliert: 5, 10, 12.5, 16.7, 25 und 50 Hz
Durch die Superposition der Einzelzuckungen nehmen die Spannungsmaxima mit der Frequenz der Doppelreize zu:
Ist der Reizabstand größer als die Dauer einer Einzelzuckung (in diesem Beispiel bei Reizfrequenzen von unter 7 Hz), so verbleibt nach der ersten Zuckung kein Kontraktionsrückstand und der zweite Reiz führt zu keiner Erhöhung des Kontraktionsmaximums (in diesem Beispiel bei Reizfrequenzen unter etwa 7Hz).
Mit Erhöhung der Reizfrequenz nimmt das Kontraktionsmaximum zu, da der Kontraktionsrückstand nach der ersten Reizung zunimmt.
Bei Frequenzen über 20-30Hz führt eine weitere Erhöhung der Reizfrequenz zu keiner weiteren Erhöhung des Kontraktionsmaximums, da der zweite Reiz auf dem Kontraktionsmaximum des Ersten aufsetzt.
Die physiologisch relevante Kontraktion ist die tetanische. In vivo werden die Muskelfasern über die Motoneurone durch Salven von Aktionspotentialen aktiviert. Aufgrund der Superposition von Einzelzuckungen nimmt die Kontraktionsstärke mit der Reizfrequenz zu.
Wie in der Realität, so kann auch der virtuelle Muskel in SimMuscle durch Salven von Aktionspotentialen gereizt werden:

Abb. 6.1.5: Tetanische Kontraktionen des simulierten Skelettmuskels bei verschiedener Reizfrequenz. Bei einer Reizfrequenz von mehr als 20Hz ist der Tetanus vollständig.
Man spricht von einem vollständigen Tetanus, wenn das Reizintervall kürzer, als etwa 1/3 der für eine Einzelzuckung benötigten Zeit beträgt (in Abb. 6.1.5 bei mehr als etwa 20 Hz) [23]. In diesem Fall bleibt der Kalziumionenspiegel innerhalb des Muskels auch zwischen den Reizen erhöht, weil die Kalziumpumpe in einem kurzen Reizintervall die Kalziumionen nicht vollständig aus dem Longitudinalsystem des sarkoplasmatischen Retikulums ausräumen kann.
Bei langanhaltender tetanischen Kontraktion nimmt die intrazelluläre Kalzium-Konzentration ab und führt so zur Ermüdung des Muskels [1].
Der Muskel ist ein elastisches Gebilde. Wird er mit Gewichten belastet, so dehnen sich die Fasern und der Muskel wird passiv angespannt.
Diese Elastizität kommt hauptsächlich durch die den kontraktilen Strukturen parallel geschalteten elastischen Elemente zustande (z.B. das Sarkolemm um die Muskelfaser und bindegewebige Strukturen innerhalb des Muskels) [23].
Wie ein realer Muskel, so zeigt auch der virtuelle Muskel elastisches Verhalten:

Abb. 6.1.6: Ruhedehnungskurve des simulierten Skelettmuskels. Das linke Bild zeigt den Bildschirm des Oszilloskops. Das rechte Bild stellt die Ruhedehnung in Abhängigkeit von der Gewichtsbelastung dar.
Anders als bei einer Metallfeder nimmt die Dehnung nicht linear mit der Spannung zu. Die Kurve ist um so stärker gekrümmt, je größer die Gewichtsbelastung ist. Der Elastizitätsmodul (Spannungsänderung pro Längenänderung) des ruhenden Muskels nimmt also mit der Dehnung zu [3].
Zur Erzeugung isometrischer Kontraktionen wird der erschlaffte, ruhende Muskel an beiden Enden in der Versuchsapperatur festgespannt, so daß er sich bei der Aktivierung zwar unter Kraftentwicklung anspannen, jedoch nicht verkürzen kann.
Wie bereits in Kapitel 3.1 dargestellt, hängt die von einer Muskelfaser entwickelte aktive Kraft von der Sarkomerlänge ab (-> Abb. 3.1.5). Die Muskelkraft hängt somit von seiner Vordehnung ab:

Abb. 6.1.7: Kurve der (aktiven) isometrischen Kontraktionsmaxima des simulierten Skelettmuskels. Durch Adjustierung der Kraftmessungen, taucht die passive Muskelspannung auf Grund der Gewichtsbelastung in der dargestellten Beziehung nicht auf.
Die Kurve der isometrischen Maxima des (virtuellen) Muskels spiegelt die Sarkomerlängen-Kraft-Beziehung wieder.
Bei leichter Vordehnung zeigt die Kurve ein Maximum (in diesem Beispiel 2.8 N bei einer Vordehnung von ca. 50 g). Es entspricht seiner natürlichen Vordehnung in Ruhe.
Der ruhende Muskel wird bei isotonischen Versuchsbedingungen an einem Ende aufgehängt und durch Gewichte, die am anderen Ende befestigt werden, passiv vorgedehnt.
Im Gegensatz zur isometrischen Kontraktion, bei der das Gewicht nicht angehoben wird, leistet der Muskel bei der isotonischen Kontraktion mechanische Arbeit. Sie errechnet sich aus dem Produkt der Muskelverkürzung (Hubhöhe) und der Gewichtsbelastung.
Die Hubhöhe, die der Muskel bei der Kontraktion erreicht, ist, ebenso wie die Muskelkraft, eine Funktion von der Gewichtsbelastung. Ebenso zeigt sie ein Maximum bei geringer Vordehnung:
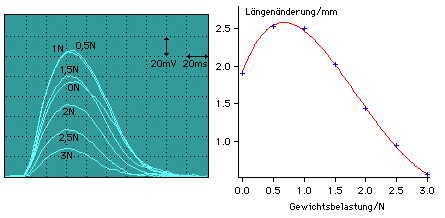
Abb. 6.1.8: Kurve des aktiven Anteils der isotonischen Kontraktionsmaxima. Durch Adjustierung der Längenmessungen, taucht die passive Längenänderung auf Grund der Gewichtsbelastung in der dargestellten Beziehung nicht auf.
Da sich der Muskel bei isotonischer Kontraktion verkürzen kann, verringert sich seine mittlere Sarkomerlänge während der Kontraktion im Vergleich zum ruhenden, vorgedehnten Muskel. Aus diesem Grunde liegt das Maximum der Kurve der isotonischen Kontraktionsmaxima bei einer etwas höherern Gewichtsbelastung (in diesem Falle bei etwa 65g) als bei der isometrischen Kontraktion.
Die Verkürzungs-Geschwindigkeit eines Muskels ergibt sich aus der Kontraktions-Geschwindigkeit der einzelnen Sarkomere und der Anzahl der hintereinandergeschalteten Sarkomere. Sie ist bestimmt durch die Geschwindigkeit, mit der Actin- und Myosinfilamente aneinander vorbei gleiten können (d.h. durch die Dauer eines Gleitzyklus).
Die maximale Verkürzungs-Geschwindigkeit eines Sarkomers tritt bei der lastfreien Kontraktion auf und nimmt mit zunehmender Belastung des Muskels in hyperbolischer Weise ab:

Abb. 6.1.9: Die Last-Geschwindigkeits-Beziehung des virtuellen Muskels bei isotonischen Einzelzuckungen. Die Verkürzungs-Geschwindigkeit wurde über die Tangente des ansteigenden Bereiches der jeweiligen Kontraktionskurve bestimmt.
Über die Beziehung Leistung = Kraft * Geschwindigkeit ergibt sich die Leistungskurve des Muskels:

Abb. 6.1.10: Leistungskurve eines Skelettmuskels in Abhängigkeit von der Gewichtsbelastung [3].
Die Hill'sche Beziehung besagt, daß (bei Unterstützungs-Kontraktionen) das Maximum der Muskelleistung bei etwa 30% der maximal zu hebenden Gewichtsbelastung liegt.
Da die isotonischen Kontraktionen in der Simulation nicht unterstützt werden, ist das maximal zu hebende Gewicht im Vergleich zur Unterstützungskontraktion jedoch erheblich geringer: In dem in Abb. 6.1.10 gezeigten Beispiel beträgt sie etwa 3.5N. Die maximale Leistung von etwa 80mW liegt bei ca.1.7N.
6.2 Ergebnisse von SimVessel
Das Antrum-Präparat einer Ratte ist ein typisches Beispiel phasisch aktiven Muskelgewebes vom Single-Unit-Typ. Durch Zugabe von ACh werden die muskarinischen Rezeptoren stimuliert, welche zu einer Erhöhung der myogenen elektrischen Kopplung führt: Der Tonus des Muskels steigt und die Frequenz und Amplitude der phasischen Aktivität nimmt zu:

Abb. 6.2.1: Kontraktionskurve des virtuellen Antrum-Präparates als Beispiel phasisch rythmuscher Kontraktionen. Durch Gabe von Acetylcholin wird der Tonus und die phasische Aktivität gesteigert. Die angegebenen Wirkstoffkonzentration sind auf das Organbad bezogen.
Die Aorta dagegen ist ein Beispiel des Multi-Unit-Types der Gefäßmuskulatur größerer Gefäße. Die Kontraktionen verlaufen tonisch:

Abb. 6.2.2: Kontraktionskurve des virtuellen Aorta-Präparates als Beispiel tonischer Kontraktionen. Durch Gabe von Noradrenalin wird der Tonus des Muskels gesteigert. Die angegebenen Wirkstoffkonzentration sind auf das Organbad bezogen.
Durch Dehnung spontan aktiver Muskeln werden ihre Schrittmacherzellen stärker depolarisiert und dadurch die Frequenz der Aktionspotentiale (und somit der Tonus des Muskels) erhöht. Diese dehnungsreaktive Kontraktion ist z.B. wichtig für die Autoregulation der Arteriolen.
Zur Vordehnung der Muskel stehen in dem Programm SimVessel zwei Gewichte zu je einem halben Gramm zur Verfügung. Die Belastung der (virtuellen) Muskel führte zu folgenden Messkurven:

Abb. 6.2.3 Die Dehnung autoregulierter glatter Muskeln führt zu einer Verstärkung der Kontraktion - Bayliss Effekt. Er wird sowohl bei Gefäß- als auch bei Eingeweidemuskulatur beobachtet. Im Programm SimVessel wurden die beiden Präparate nacheinander mit je zwei Gewichten zu je einem halben Gramm belastet.
Wie in der Realität zeigen beide Präparate den sogenannten Bayliss-Effekt: Die Autoregulation des Muskels führt bei mechanischer Belastung zur Verstärkung der Kontraktion.
Bei phasischen Muskeln erhöht sich neben dem Tonus auch die Amplitude und Frequenz der spontanen Kontraktionen.
Die Nervale Innervation geschieht über Neurotransmitter. Noradrenalin ist der Überträgerstoff der meisten postganglionären sympatischen Nervenfasern - Achtylcholin der Neurotransmitter aller postganglionären parasympatischen Nervenfasern [5].
Durch Gabe von ACh zu einem Präparat aus dem Magen-Darm-Trakt (z.B. Antrum) werden die muskarinischen ACh-Rezeptoren der Schrittmacher-Zellen erregt. Dadurch werden sie bis nahe an das Schwellenpotential vordepolarisiert und so die Frequenz der Aktionspotentiale erhöht. Dieses hat eine Verstärkung der Kontraktion zur Folge:

Abb. 6.2.4: Die Dosis-Wirkungs-Kurve des virtuellen Antrum-Präparates. Aufgetragen ist die tonische Verkürzung des Präparates (in Prozent der Gesamtlänge).
Die Muskulatur des Antrums ist ein Beispiel für glatte Muskulatur des single-unit-Typs. Der myogene Tonus wird vorwiegend über parasympatischen Nerven (Acetylcholin vermittelt) verstärkt.
Die Aorta weist nur wenige muskarinische ACh-Rezeptoren auf, dafür eine hohe Dichte an Alpha1-Rezeptoren und Beta1-Rezeptoren dafür fast keine Beta2-Rezeptoren.
Noradrenalin wirkt hauptsächlich auf die (stimulierenden) Alpha1-Rezeptoren und weniger auf die (stimulierenden) Beta1-Rezeptoren und die (hemmenden) Beta2-Rezeptoren der Blutgefäße.
Die vorwiegend IP3 vermittelte Reaktion der Gefäßmuskulatur auf die Stimulierung der Alpha1-Rezeptoren besteht, wie bereits erwähnt, in der Freisetzung von Kalzium aus dem Sarkoplasmatischen Retikulum und führt auf diese Weise zur Kontraktion des Muskels:

Abb. 6.2.5: Beispiel der Dosis-Wirkungs-Kurve des virtuellen Aorta-Präparates. Aufgetragen ist die tonische Verkürzung des Präparates (in Prozent der Gesamtlänge).
Die Dosis-Wirkungs-Kurven der beiden virtuellen Präparate zeigen die typischen sigmoidalen Verläufe von Dosis-Wirkungskurven.
Zwischen catecholaminer (NA) und cholinerger (ACh) Innervation gibt es einen mehr oder weniger ausgeprägten Antagonismus. So hat ACh auf die Gefäßmuskulatur und NA auf die Eingeweidemuskulatur eine hemmende Wirkung:

Abb. 6.2.6: Einfluß von Noradrenalin auf die Wirkung von Acetylcholin. Die ACh-Dosis-Wirkungs-Kurve (obere Kurve) des virtuellen Antrum-Präparates ist unter Zugabe von Noradrenalin etwas abgeflacht (untere Kurve).
Während ACh auf die Muskulatur des Antrums kontraktionssteigernd wirkt, bewirkt Noradrenalin oder Adrenalin das Gegenteil: Durch die Stimulation der Alpha-Rezeptoren des Antrums wird der Kalzium-Abtransport aus der Muskelzelle verstärkt. Die Stimulation der Beta-Rezeptoren führt zur vermehrten Bindung von intrazellulärem Kalzium [2]. Dieses führt zur Hyperpolarisation der Schrittmacher-Zell-Membranen, wodurch die Frequenz der Aktionspotentiale und somit der Tonus des Muskels abnimmt [23].
Mit Hilfe entsprechender Rezeptor-Antagonisten kann die Wirkung der Neurotransmitter unterdrückt werden.
Die muscarinergen ACh-Rezeptoren lassen sich z.B. mit hoch dosiertem Atropin vollständig blockieren.

Abb. 6.2.7 Einfluß von Atropin auf die ACh-Wirkung. Die ACh-Dosis-Wirkungs-Kurve (obere Kurve) des virtuellen Antrum-Präparates ist unter Zugabe von Atropin nach rechts verschoben (untere Kurve).
Auf Grund der Konkurrenz von ACh und Atropin um die Rezeptoren ist die Dosis-Wirkungs-Kurve in Richtung höherer ACh-Konzentrationen verschoben: Bei einer Atropin-Konzentration von z.B. 2*10-7 M setzt der ACh-Effekt erst bei Konzentrationen ab etwa 10-7 M ein.
Die Sympatikus-Effekte werden i.a. über mehrere Rezeptortypen vermittelt, so daß ein Rezeptor-Antagonist (z.B. Alpha- oder Betablocker) für sich allein die NA-Effekte nicht vollständig unterdrücken kann.
Bei der Aorta wirkt Phentolamin als Alpha-Rezeptor-Blocker und Propranolol hemmend auf die Beta1- und Beta2-Rezeptoren:

Abb. 6.2.8: Kompetitive Hemmung der Alpha- und Beta-Rezeptoren des virtuellen Aorta-Präparates durch spezifische Rezaptorblocker. Der Zusatz von Phentolamin (Alpha-Blocker) hemmt nur einen Teil der Noradrenalinwirkung. Erst die zusätzliche Gabe eines Beta-Blockers (Propranolol) kann eine vollständige Blockade bewirken.
Mit Hilfe eines Alpha-Rezeptor-Blockers (z.B. Phentolamin) kann selbst bei hoher Dosierung nur ein Teil der Noradrenalin Wirkung gehemmt werden. Erst die zusätzliche Gabe eines Beta1- und Beta2-Rezeptor-Blockers kann (entsprechend hoch dosiert) eine vollständige Hemmung der NA-Wirkung bewirken.
Eine andere Möglichkeit der Hemmung ist die Blockade der Kalzium-Kanäle des Sarkolemms und somit der elektro-mechanischen-Kopplung durch Kalzium-Blocker (z.B. Verapamil).
Die nicht-kompetitive und unspezifische Hemmung ist bei allen glattmuskulären Zellen wirksam:

Abb. 6.2.9: Nicht-kompttitive Hemmung der Kalzium-Kanäle des virtuellen Antrum-Präparates durch Verapamil.

Abb. 6.2.10: Die nicht-kompttitive Hemmung der Kalzium-Kanäle des virtuellen Aorta-Präparates durch Verapamil.
Im Gegensatz zur kompetitiven Hemmung kann die hemmende Wirkung von Verapamil nicht durch entsprechend hohe Neurotransmitter-Konzentration wieder kompensiert werden.
6.3 Ergebnisse von SimHeart
Das Herz ist gut mit sympathischen und parasympathischen (vagalen) Nerven versorgt. Die wichtigsten Neurotransmitter sind Acetylcholin (ACh) bzw. Adrenalin (Adr). Diese Substanzen binden an Membranrezeptoren der Herzmuskelzellen und steuern dadurch Frequenz, Erregungsleitung, Kontraktionskraft und Erregbarkeit des Herzens.
Wie beim realen Herzen, so wirkt auch in dem simulierten Experiment Adrenalin, der Neurotransmitter der sympatischen Nerven, positiv inotrop (Herzkraft steigernd) und positiv chronotrop (steigernd auf die Erregungsbildung und somit Herzfrequenz steigernd):

Abb. 6.3.1: Einfluß von Adrenalin auf die Herzkraft und die Frequenz des Herzens im simulierten Experiment.
Acetylcholin, der Neurotransmitter der parasympatischen Nerven, wirkt negativ inotrop (Herzkraft senkend) und negativ chronotrop (senkend auf die Herzfrequenz):

Abb. 6.3.2 Die negativ inotrope und negativ chronotrope Wirkung von Acetylcholin am Herzen in der Simulation.
Wie bei vielen glattmuskulären Organen existiert auch am Herzen ein funktioneller Antagonismus zwischen catecholaminerger und cholinerger Innervation, d.h. wenn Adr einen verstärkenden Effekt auf die Herzkontraktion hat, zeigt ACh einen hemmenden Effekt (s.o.). Im Gegensatz zu einem von der zentralen Innervation isolierten Präparat, wie beim Langendorff-Herzen in diesem Versuch, unterliegt das Herz in vivo einem andauernden Einfluss beider Systeme mit jeweils unterschiedlicher Stärke - je nach aktueller Anforderung. Die Aktivierung des Sympathikus wird i.a. mit einer sog. ergotropen Reaktionslage (Bereitschaftsreaktionen, verstärkte Herzaktivität) in Verbindung gebracht während bei sog. trophotroper Reaktionslage (Erholungsphase, geringere Anforderungen an die Herzaktivtät) der Parasympathikus überwiegt:

Abb. 6.3.3: Funktioneller Antagonismus zwischen Adrenalin und Acetylcholin im simulierten Experiment.
Die Wirkung der Neurotransmitter kann durch spezifische Blockade ihrer Rezeptoren mit entsprechenden Rezeptor-Antagonisten unterdrückt werden (kompetitive Hemmung). Dabei konkurriert z.B. Atropin (Atr) mit ACh um die muscarinergen Alpha-Rezeptoren:

Abb. 6.3.4: Der Effekt von Atropin auf die Herzkraft und die Frequenz des Herzens in der Simulation. Durch Blockierung der muskarinischen ACh-Rezeptoren des Herzens, wird der negativ inotrope und negativ chronotrope Effekt von Acetylcholin abgeschwächt.
Das in diesem Versuch bereitgestellte Phentolamin (Phe) bindet an adrenerge Alpha-Rezeptoren, die beim Herzen praktisch keine Rolle spielen. Dahingegen gehört Propanolol (Pro) zu den auch therapeutisch sehr wichtigen Beta-Blockern, da es die Adr-Wirkung durch Bindung an Beta-Rezeptoren blockiert und somit in der Lage ist, Tachykardien und die Gefahr von Arhythmien zu vermindern.

Abb. 6.3.5: Der Effekt des Beta-Blockers Propranolol auf die Herzkraft und die Frequenz des Herzens im simulierten Experiment.. Durch Blockierung der Beta1-Rezeptoren des Herzens, wird der inotrope und chronotrope Effekt von Adrenalin abgeschwächt.
Kalzium spielt nicht nur als second-messenger zur Vermittlung der Adr-und ACh-Effekte eine wichtige Rolle sondern ist, wie auch bei allen anderen Muskelzellen, vor allem für die elektromechanische Kopplung von entscheidender Bedeutung. Dabei wird bei den Herzmuskelzellen auch das aus intrazellulären Speichern freigesetzte Kalzium durch den extrazellulären Einstrom von Kalzium-Ionen gesteuert, d.h. die Höhe des Kalziumeinstroms bestimmt letztlich die Kontaktionskraft des Herzmuskels. Kalzium-Kanal Blocker oder Kalzium-Antagonisten, wie beispielsweise Verapamil (Ver) vermindern den Kalzium-Einstrom in die Hermuskelzellen (nicht-kompetitive Hemmung). Diese Substanzen haben aber auch vielfältige Effekte an anderen Organsystemen. Besonders zu berücksichtigen sind beispielsweise die vasodilatatorischen Effekte (-> SimVessel).

Abb. 6.3.6 Der Effekt von Verapamil auf die Herzkraft und die Frequenz des Herzens in der Simulation. Durch Blockierung der Kalzium-Ionen-Kanäle, wird der inotrope und negativ Effekt von Adrenalin nicht-kompetitiv abgeschwächt.
Eine weitere Gruppe herzwirksamer Pharmaka bilden die Herzglykoside oder Digitalisglykoside, zu denen beispielsweise Gamma-Strophanthin (gSt) gehört. Die fast ausschließliche Wirkung dieser Stoffe aufs Herz erklärt man sich mit der Bindung der Digitalisglykoside an bestimmte Rezeptorproteine der Herzmuskelzellmembran [30].
Die Wirkungsweise von Herzglykosiden ist noch nicht in allen Punkten vollständig geklärt. Man geht i.a. davon aus, daß sie die Aktivität der Na+/K+-Pumpe reduzieren wodurch sich der Na+-Gradient über der Zellmembran erniedrigt. Dadurch verringert sich der passive Na+-Einstrom und damit auch der über den Na+/Ca2+-Austausch daran gekoppelte Ca2+-Ausstrom. Dieses führt zu einer intrazellulären Erhöhung der Ca2+-Konzentration, was letztlich die Ursache für die herzkraftsteigernde Wirkung der Digitalisglykoside sein soll.
Allerdings erhöhen Herzglykoside auch die Neigung zu Arhythmien, was möglicherweise mit depolarisierenden Effekten einer gehemmten NA/K-Pumpe zusammenhängt. Damit haben die Herzglykoside oft eine nur sehr geringe therapeutische Breite und erfordern im klinischen Einsatz sorgfältigste Einstellung.

Abb. 6.3.7: Der Einfluß von Herzglykosiden auf den Kontraktionsverlauf des virtuellen Herzens. Schreiber-Aufzeichnung (A) zeigt das Mechanogramm des Herzens vor Applikation von Gamma-Strophantin Die Gabe von 5*10-7 M Gamma-Strophantin führt zu einer Steigerung der Herzkraft bei gleichzeitiger Verminderung der Schlagfrequenz und zu einem AV-Block zweiten Grades.
In dem in Abbildung 6.3.7 dargestellten Beispiel wird die Kontraktionskraft des Herzens um ca. 40% gesteigert und die Herzfrequenz von etwa 120/min um mehr als die Hälfte gesenkt. Deutlich zu sehen ist darüber hinaus der partielle AV-Block zweiten Grades (Aussetzer).
Die durch die Algorithmen berechneten Messkurven entsprechen den in den realen Experimenten zu erwartenden Kurven und geben somit die Realität sehr gut wieder (-> z.B. Abb. 5.7.6, 5.7.7). Die physiologischen Parameter werden mit Hilfe des Zufallsgenerators bei jedem Aufruf der Programme innerhalb realistischer Grenzen festgelegt. Auf diese Weise wird der physiologischen Varianz der Präparate Rechnung getragen.
Das zeitliche Verhalten der Simulationen entspricht der Realität. Dieses Echtzeitverhalten wird auch durch Animationen, die der Anwender auslöst (z.B. Bewegung von Objekten, Betätigung von Buttons ...) nicht beeinflußt.
Im Fall von SimMuscle konnte dieses durch einen modalen Versuchsablauf erreicht werden. Da der Anwender nach Betätigung des Stimulusknopfes die Möglichkeitet hat, die Animation jederzeit abzubrechen und er in diesem Modus die Aufmerksamkeit auf die Aufzeichnung der Messkurven richtet, stellt dieses keine Einschränkung dar.
Die Programme SimVessel und SimHeart sind weitgehend multitaskingfähig, so daß alle Aktionen parallel ablaufen können, ohne daß das Echtzeitverhalten der Muskel-Simulationen beeinträchtigt wird. Einige Funktionen der Macintosh Toolbox (z.B. PopUpMenus und AlertBoxen) passen allerdings nicht in das Konzept der multitaskingfähigen Echtzeitprogrammierung, da ihre Ausführzeiten länger als die Durchlaufzeit der Echtzeitschleife sind. Der Versuchsablauf wird unterbrochen solange diese Elemente aktiv sind. Bei der Realisation wurde versucht weitestgehend auf diese Elemente zu verzichten, doch in einigen Fällen wäre es nicht sinnvoll gewesen sie durch aufwendige echtzeitfähige Eigenlösungen zu ersetzen:
In den Laborbildschirmen von SimVessel und SimHeart wird ein Standard PopUpMenu der Macintosh Toolbox zur Auswahl der Lösungsreihen verwendet. Dieses erhöht den Wiedererkennungswert des Elementes und erleichtert dadurch die Bedienung. Da die Bedienung des PopUpMenus nur kurze Zeit in Anspruch nimmt und die Aufmerksamkeit des Anwenders auf die Auswahl einer Lösungsreihe gerichtet ist, wird die Unterbrechung der Simulation nicht als störend empfunden.
AlertBoxen werden in den Programmen nur in Situationen eingesetzt, wo es zu einem eventuell ungewollten Datenverlust kommen kann: vor dem Verlassen der Programme und vor dem Löschen bzw. Überschreiben von Karteikarten. In diesen Fällen sollte die Aufmerksamkeit des Anwenders bei der Entscheidung liegen, ob dieser Datenverlust gewollt ist, oder nicht.
Das kurz vor dem Drucken aufgerufene Standard-Druckermenu ist ebenfalls nicht echtzeitfähig. Trotsdem erscheint es in diesem Fall sinnvoll, die Standard-Druckfunktion des Betriebsystems zu verwenden, denn sie gewährleistet die Kompatibilität zu allen zukünftigen Druckersystemen, die von Apple unterstützt werden [49]. Eine Anpassung an verschiedene Sprachen ist auf diese Weise ebenfalls nicht notwendig, da die Systemsoftware in vielen Sprachen existiert.
Der optische Eindruck der Labore und die Funktionsweise der Geräte sind sehr realistisch. In den Programmen SimVessel und SimHeart mußte allerdings aus Platzgründen auf eine 3D-Darstellung der Geräte verzichtet werden.
Die Programme zwingen dem Anwender kein didaktisches Schema auf - die Reihenfolge der Einzelversuche und der Einstellung der Versuchsparameter können wie in realen Experimenten frei gewählt werden. Der Anwender hat wie in realen Versuchen die Möglichkeit Fehler zu machen und durch diese zu lernen.
Mit den Programmen lassen sich alle wichtigen Einzelversuche der simulierten Experimente durchführen. Dadurch ist die Möglichkeit gegeben, daß der Dozent seine im realen Praktikum erprobten Praktikumsanleitungen im großen und ganzen weiterverwenden kann.
In den Programmen SimVessel und SimHeart war es nicht immer möglich Realitätsnähe und Anwenderfreundlichkeit gleichzeitig zu realisieren. In diesen Fällen wurde Priorität auf die Anwenderfreundlichkeit gelegt, um die Durchführung der Versuche zu erleichtern und die Aufmerksamkeit des Anwenders nicht von den Lerninhalten abzuziehen:
Vorversuche zur Auswertung der Schreiberaufzeichnungen zeigten, daß es in diesem Fall nicht möglich ist in angemessener Entwicklungszeit Relitätsnähe und Anwenderfreundlichkeit miteinander zu verbinden. Eine befriedigende Lösung besteht darin, bei der Auswertung auf realitätsnahe Elemente zu verzichten, diese Elemente in einem eigenen Bildschirm zusammenzufassen und diesen von dem Laborbildschirm zu trennen. So ist Realitätsnähe bei der Durchführung und Anwenderfreundlichkeit bei der Auswertung des Versuchs gegeben.
Doch auch in den Laborbildschirmen mußten virtuelle Elemente eingebaut werden, um die Anwenderfreundlichkeit zu erhöhen. Das PopUpMenu stellt eine platzsparende und leicht zu bedienende Lösung zur Auswahl der Substanzen dar. Sie hat außerdem einen höheren Wiedererkennungseffekt als andere Lösungen.
Das Schreiben von wichtigen Notizen auf das bewegliche Plotterpapier wird von den Programmen automatisch vorgenommen. Auf diese Weise wird der Anwender nicht durch die Bedienung zwangsläufig realitätsferner und schwer zu bedienender Funktionen abgelenkt. Für eigene Notizen kann er die auf das Papier geschriebene laufende Numerierung nutzen.
Die Versuche zur glatten Muskulatur sind in der Realität sehr zeitaufwendig. Die virtuelle Zeitraffer-Uhr in SimVessel dient dazu, die Geschwindigkeit des Versuchsablaufs zu erhöhen und damit dem Anwender die Möglichkeit zu geben sich alle Lerninhalte in angemessener Zeit zu erschließen.
Die drei Programme zeichnen sich durch ihre hohe Anwenderfreundlichkeit:
Wichtig bei der Gestaltung von Benutzeroberflächen ist es, alle notwendigen Funktionen zu integrieren und gleichzeitig eine Überladung mit unnötigen Funktionen zu vermeiden, um den Anwender nicht von den Lerninhalten abzulenken [9]. Aus diesem Grunde wurden die Geräte nur mit Funktionen ausgestattet, die für den Versuchsablauf sinnvoll sind. So wurde z.B. auf die verschiedenen Möglichkeiten der Triggerung, die es bei Oszilloskopen normalerweise gibt, verzichtet.
Die drei Programme sind weitgehend selbsterklärend. Durch die realitätsnahe Optik der Geräte wird ihre Bedienung und Funktion von selbst verständlich.
Die Bedienung der einzelnen Elemente erfolgt, bis auf wenige Ausnahmen (s.o.), mit der Maus. Jeder Mausklick auf ein bedienbares Element führt sofort zu einem visuellen Effekt, der anzeigt, daß das Programm die Benutzeraktion registriert hat. Soundeffekte unterstützen diesen Effekt.
Die Bedienbarkeit eines Elements wird beim Überfahren seiner HotRegion durch eine Cursoränderung angezeigt. Bei anklickbaren Elementen wird der Cursor zu einer zeigenden Hand, bei verschiebbaren Elementen zu einer offene Hand. Relativ große HotRegions erleichtern die Bedienung der Elemente.
Komplexe Abläufe können durch Automatisierung bzw. Teilautomatisierung vereinfacht werden. So werden in den Programmen SimVessel und SimHeart alle wichtigen Aktionen des Anwenders automatisch auf dem Schreiberpapier protokolliert.
Der komplizierte Spülvorgang des Messbechers in SimVessel wird durch das Betätigen des Verschlußventils ausgelöst und läuft danach automatisch bis zum Ende ab.
In SimMuscle wird die Arretierung des Transducers bei isometrischen Messungen vor dem Einhängen des Muskels und der Gewichte automatisch gelöst und danach wieder aktiviert.
Die Bewegung von Objekten wurde durch feste Start- und Endpunkte vereinfacht. Kommt das Objekt in die Nähe eines solchen Punktes, wird es an diesem Punkt abgelegt.
Bei einigen Objekten wird dem Anwender die Möglichkeit gegeben, sie auf verschiedene Weise zu bedienen. Dieses hat den Vorteil, daß unterschiedliche intuitive Vorgehensweisen unterstützt werden. So können die Drehreglerund die Auswahl des aktiven Karteifachs im Auswertebildschirm auf zweifache Weise bedient werden (-> Kapitel 5.4 und 5.9).
Sollten bei der Durchführung des Versuches dennoch Fragen auftreten, kann der Anwender jederzeit die Hilfefunktion aufrufen. Sie liefert alle nötigen Informationen über die Handhabung der dargestellten Geräte.
Die Human Interface Guidelines für Benutzeroberflächen [4] wurden weitgehend eingehalten. Folgende Abweichungen erschienen jedoch sinnvoll:
Die Standard-Menuleiste wurde ausgeblendet, um den realistischen Eindruck der Labore zu erhöhen. Außerdem konnte so die zur Verfügng stehende Bildschirmfläche vergrößert werden.
Die Navigationsfunktionen wurden auf das Notwendigste begrenzt, um den Anwender nicht von den Lerninhalten abzulenken. In den Programmen SimVessel und SimHeart wurde eine verkürzte Funktionsleiste am linken Bildrand plaziert, welches ebenfalls zur Vergrößerung der zur Verfügng stehenden Bildschirmfläche beitägt.
Um die Realitätsnähe zu erhöhen, wurde das Design der Buttons freier gestaltet, als es von den strengen Richtlinien der Human Interface Guidelines empfohlen wird.
8 Literaturverzeichnis
[1] Allen DG, Westerblad H, Lee JA, Lännergren J (1992): "Role of exitation contraction coupling in muscle fatigue", Sports Med 13:116-126.
[2] William F. Ganong; Jack and DeLoris Lange (1991): "Review of medical physiology", 15th Edition, Prentice-Hall International (UK) Limited, London.
[3] Robert M. Berne; Matthew N. Levy; Richard A. Murphy (1990): Principles of physiology, International Student Edition, Wolfe Publishing Ltd, London.
[4] Apple Human Interface Guidelines, Reading Massachusetts 1987.
[5] S. Silbernagel und A. Despopoulos (1991): "Taschenatlas der Physiologie", Georg Thieme Verlag Stuttgart.
[6] B. Kratz (1985): "Nerv, Muskel,Synapse - Einführung in die Elektrophysiologie", Georg Thieme Verlag Stuttgart.
[7] R. Drath, E. Estel, H. Lindner, W. Polenz, R. Schönefeld (1984): "Mathematik, Physik, Chemie - Grundwissen zum Nachschlagen", VMA-Verlag Wiesbaden.
[8] H. J. Döring; H. Dehnert (1990): "Das isoliert perfundierte Herz nach Langendorff", aktualisierte Kurzfassung, Biomesstechnik-Verlag, March-Hugstetten.
[9] Deborah J. Mayhew (1992): "Principles and Guidelines in Software User Interface Design", Englewood Cliffs, Prentice Hall.
[10] Dr. H Siegel und Mitarbeiter der beteiligten Institute (1993): "Anleitung zum Integrierten Praktikum Biochemie, Phsyiologie", Marburg.
[11] Rayment I, Holden HM, Withaker M, Yohn CB, Lorenz M, Holmes KC, Milligan RA (1993): "Structure of actin-myosin complex and its implications for muscle contraction", Sience, 261:58-65.
[12] Infante AA, Davies RE (1962): "Adenosintriphosphate breakdown during a single isotonic twitch of frog sartorius muscle", Biochem Biophys Res Commun 9:410.
[13] Huxley HE (1973): "Structural changes in the actin and myosin contracting filaments during contraction", Cold spring Harb Symp Quant Biol 37:361.
[14] Phillips GN, Fillers JP, Cohen C (1986): "Tropomyosin crystal structure and muscle regulation", J Mol Biol 192:111-131.
[15] Brenner B (1988): "Effect of calcium in the cross-bridge turnover kinetics in skinned single rabbit psoas fibers". Proc Natl Acad Sci USA 85:3265-3269.
[16] Rüegg JC (1992): "Calcium in muscle contraction", 2nd edn. Springer, Berlin Heidelberg New York.
[17] Sugi H (1992): "Muscle contraction and cell motility", Springer, Berlin Heidelberg New York.
[18] Hasselbach W, Makinose J (1963): "Über den Mechanismus des Kalziumtransports durch die Membran des sarkoplasmatischen Retikulums". Biochem Z 339:94.
[19] Reedy MK (1993): "Myosin-actin motors. The partnership goes atomic". Structure 1:1-15.
[20] E. Braunwald, J. Ross, EH. Sonnenblick (1967): "Mechanisms of contraction of the normal and failing heart". N Engl J Med 277:794.
[21] Fleckenstein A (1983): "Calcium antagonism in heart and smooth muscle - experimental facts and therapeutic prospects", Wiley, New York.
[22] Rüegg JC (1986): "Calcium in muscle activation - a comparative approach", Springer, Berlin Heidelberg New York.
[23] Schmidt Thews (1995): "Einführung in die Physiologie des Menschen", Springer, Berlin.
[24] David Allcott (1985): "Symantec C++ Compiler Guide (Version 8)", Symantec Cooperation USA.
[25] David Allcott (1985): "Symantec C++ User's Guide (Version 8)", Symantec Cooperation, USA.
[26] Dr. Hans A. Braun (1994-1996): "Praktikumsanleitungen zu dem Programm: SimMuscle", Marburg.
[27] Dr. Hans A. Braun (1994-1996): "Praktikumsanleitungen zu dem Programm: SimVessel", Marburg.
[28] Dr. Hans A. Braun (1994-1996): "Praktikumsanleitungen zu dem Programm: SimHeart", Marburg.
[29] L. Jaenicke, B. Alberts, D.Bray, J. Lewis, M. Raff, K. Roberts, J.D. Watson (1990): "Molekularbiologie der Zelle", VCH, Weinheim.
[30] N. Boss et al. (1993): "Roche Lexikon Medizin", Urban und Schwarzenberg, München.
[31] Rufus Rieder (1993): "Konzeption und Realisierung der Multimedia-Applikation MacFrog: Der Frosch-Nerven-Versuch auf Apple Macintosh Computer", Diplomarbeit Marburg.
[33] Wilkie DR (1950): "The relation between force and velocity in human muscle". J Physiol (London) 110:249-280.
[34] Huxley HE, Hanson J (1954): "Changes in the cross-striation of muscle during contraction and stretch and their structural interpretation". Nature 173:973.
[35] Huxley AF (1974): "Muscular contraction". J Physiol (London) 243:1-43.
[36] Jeewell BR, Wilkie DR (1960):"The mechanical properties of relaxing muscle". J Physiol (London) 152:30-47.
[37] Bagshaw CR (1992): "Muscle contraction", 2nd edition, Chapman and Hall, London.
[38] Wilkie DR (1983): "Muskle, Struktur und Funktion", Teubner, Stuttgart.
[39] Shepard JT, Vanhoutte PM (1975): "Veins and their control", Saunders, London.
[40] Pohl U, Lamontagne D, Bassenge E (1994): "Attenuation of coronary autoregulation in the isolated rabbit heart", Cardiovasc Res 28:414-419.
[41] Curry FE (1986): "Determinants of capillary permeability: a review of mechanisms based on single capillary studies in the frog". Circ Res 59:367-380.
[42] Furness JB, Marshall JM (1974): "Correlation of the directly observed response of mesenteric vessels of the rat to nerve stimulation and noradrenaline with the distribution of adrenergic nerves". J Physiol (London) 239:75-88.
[43] Fleckenstein A (1983): "Calcium antagonism in heart and smooth muscle - experimental facts and therapeutic prospects", Wiley, New York.
[44] Di Francesco D (1993): "Pacemaker mechanisms in cardic tissue", Annu Rev Physiol 55:455-472.
[45] Bargmann W, Doerr W (1963): "Das Herz des Menschen", Thieme, München.
[46] Bretschneider JJ, Hellige G (1976): "Pathophysiologie der Ventrikelkontraktionen. Kontraktilität, Inotropie, Suffizienzgrad und Arbeitsökonomie des Herzens", Verh Dtsch Ges Kreislaufforsch 42:14-30.
[47] Golenhofen K (1978): "Die myogene Basis der glattmuskulären Motorik". Klin Wochenschr 56:211-244
[48] Gordon AM, Huxley AF, Julian HJ (1966): "Zh variation in isometric tension with sarcomere length in vertebrate muscle fibers", J Physiol (London) 184:170.
[49] Inside Macintosh
9 Anhang
9.1 Indizierte Farben der Systempalette

Abb. 9.1.1: Die 8-Bit-Systempalette des Macintoshs besteht aus diesen 256 Farben. Einige in den Programmen verwendeten Farben (z.B. Papierfarbe und Stiftfarben in SimVessel und SimHeart) können vom Anwender geändert werden.
9.2 Muskelbilder der isometrischen Kontraktion

Abb. 9.2.1: Bilder der isometrischen Kontraktionen des Muskels in SimMuscle. Die erste Spalte zeigt die gespeicherten Bilder der Ruhedehnungen. Die restlichen Bilder werden durch Deskalierung der Ausgangsbilder von dem Programm erzeugt.
9.3 Bewegliche Objekte mit beweglichen Endpunkten

Abb. 9.3.1: Das Anhängen eines Gewichtes an einen beweglichen Haken (obere Bildreihe) und die Änderung der Cursorform (untere Bildreihe) - beides bei unveränderter Mausposition, sind Sonderfälle der Bewegungsanimation bei beweglichen Ruhepunkten.
9.4 Hintergrundbilder der beweglichen Objekte
SimVessel und SimHeart:

Abb. 9.4.1: Hintergrundbilder der Programme SimVessel und SimHeart (nur Reagenzgläser). Sie werden verwendet um das Ablegen bzw. Aufnehmen der beweglichen Objekte zu animieren.
SimMuscle:

Abb. 9.4.2: Hintergrundbilder des Programms SimMuscle. Sie werden verwendet um das Ablegen bzw. Aufnehmen der beweglichen Objekte zu animieren.
Verzeichnis der Akademischen Lehrer
Siegen: Brandt, Dahmen, Holder, Overhagen, Pingel, Radziewski, Rost, Schülke, Walenta, Wolff.
München: Binnig, de Boer, Knözinger, Löbner, Meyer-Berkhout, Fritzsch, Peisl, Rohrer, Salecker, Schenzle, Süßmann, Trinks, Volter, Wagner, Waidelich, Walther, Weigel, Wolter.
Marburg: Adamkiewicz, Banet, Beato, Beerbaum, Besedovsky, Brandt, Braun, Doll, Elsässer, Fischer, Fruhstorfer, Hasilik, Kabiersch, Kastner, Klug, Koolman, Lammel, Lang, Löffler, Lührmann, Mandrek, McGregor, Meisner, Niessing, Opper, Reichelt, Röhm, Rogausch, Schachtschabel, Schäfer, Schindler, Siegel, Sturm, Suske, Voigt, Walter, Weiner, Wendt, Wesemann, Westphal, Wiegandt.
Danksagung
Bedanken möchte ich mich zuallererst bei Dr. Martin Christian Hirsch, der mir die Chance gegeben hat an diesem Projekt mitzuarbeiten. Er ist in jeder Hinsicht die unverzichtbare Stütze des gesamten Projektes. Seine geduldige und freundschaftliche Art haben mir gezeigt, was ein gutes Arbeitsklima ausmacht.
Prof. Dr. K. Voigt gebührt ebenfalls Dank. Seine Geduld meiner Arbeit gegenüber waren ebenso wichtig für ihr Gelingen wie seine Bereitschaft, Räume und Gerätschaften für ihre Durchführung bereitzustellen. Auch dem Bundesministerium für Bildung und Forschung und dem Georg Thieme Verlag, seien an dieser Stelle für die finanzielle Unterstützung gedankt.
Dr. Hans A. Braun danke ich für die Einführung in die Muskelphysiologie und ihre mathematische Beschreibung. Seine kreative und präzise Art physiologische Sachverhalte numerisch darzustellen waren unverzichtbar.
Dank natürlich auch allen Mitarbeitern des Teams: M. Wickermann, G. Reyher, R. Rieder, Ch. Koch und F. Schäfer für die jahrelange, kollegiale Zusammenarbeit.